免疫療法正迅速發展成為(wèi)腫瘤治療的重要手段之一,越來越多(duō)地與已經成熟的腫瘤治療手段(如手術、化療、放療和靶向治療)聯合應用(yòng)于臨床。自然殺傷(NK)細胞治療已被證明可(kě)安(ān)全有(yǒu)效的用(yòng)于多(duō)種腫瘤的治療。目前,多(duō)數臨床試驗使用(yòng)來自外周血或臍帶血或NK-92細胞的原代NK細胞。然而,原代NK細胞來源受到一定的限制,例如供體(tǐ)依賴性,體(tǐ)内低持久性和遺傳修飾困難。幹細胞來源的NK細胞是同質(zhì)的,易于在克隆水平上進行基因修飾,并可(kě)以擴大到臨床規模,是目前最有(yǒu)發展前景的過繼免疫治療腫瘤的潛在細胞群。2019年《Expert Opin Biol Ther》雜志(zhì)上發表了題為(wèi)《The rise of human stem cell-derived natural killer cells for cancer immunotherapy》的綜述,重點介紹了利用(yòng)幹細胞源性NK細胞進行腫瘤免疫治療的最新(xīn)進展和提高其抗腫瘤活性的策略,現介紹如下。

1.NK細胞生物(wù)學(xué)特性及其在細胞治療中(zhōng)的作(zuò)用(yòng)
NK細胞是先天免疫系統的淋巴細胞,具(jù)有(yǒu)殺死受感染和轉化細胞的内在能(néng)力,且無需預先抗原緻敏。NK細胞通過整合激活和抑制受體(tǐ)的信号,可(kě)以将健康細胞與感染或腫瘤靶點區(qū)分(fēn)開。殺傷性免疫球蛋白樣受體(tǐ)(KIRS)和CD94-NKG2A是兩種主要的抑制性受體(tǐ),它們通過識别正常存在于健康細胞上的I類主要組織相容性複合體(tǐ)(MHC)分(fēn)子,防止NK細胞殺死自衛細胞。感染或腫瘤細胞常常下調或丢失MHC I類分(fēn)子以逃避T細胞介導的免疫監視,而被NK細胞識别和殺死。此外,NK細胞可(kě)以通過激活受體(tǐ)來激活,包括NKG2D、KIR(激活形式)、自然細胞毒性受體(tǐ)和CD16。感染細胞或腫瘤細胞通常會增加這些激活受體(tǐ)的配體(tǐ)表達。
NK細胞可(kě)以通過以下幾種不同的機制殺死靶細胞。首先,它們可(kě)以通過釋放含有(yǒu)顆粒酶和穿孔素的細胞溶解顆粒來溶解腫瘤細胞。其次,NK細胞可(kě)以通過死亡受體(tǐ)途徑誘導其表面的死亡配體(tǐ),如第一凋亡信号配體(tǐ)(FASL或CD95L)和腫瘤壞死因子(TNF)相關的凋亡誘導配體(tǐ)來觸發腫瘤細胞凋亡。此外,NK細胞還通過抗體(tǐ)依賴性細胞毒性(ADCC)途徑殺死目标,ADCC是CD16介導的關鍵效應器,使治療性單克隆抗體(tǐ)(mAbs)的部分(fēn)抗腫瘤作(zuò)用(yòng)得以實現。
近年來,過繼細胞療法已成為(wèi)治療複發和難治性惡性腫瘤的一種新(xīn)的、有(yǒu)希望的治療方法。嵌合抗原受體(tǐ)(CAR-T)療法在2017年獲得FDA批準的兩種治療白血病的産(chǎn)品中(zhōng)引起了廣泛關注。由于CAR-T療法需要多(duō)個高度專業化的步驟,這些步驟耗時且非常昂貴。此外, CAR-T療法(如細胞因子釋放綜合征(CRS)、神經毒性和腫瘤溶解綜合征)的毒性是限制這種刺激療法廣泛應用(yòng)的另一個障礙。目前,大多(duō)數臨床試驗都使用(yòng)了來自外周血(PB-NK)的NK細胞或來自臍帶血(UCB-NK)的NK細胞,這些細胞來源依賴于供體(tǐ),而不是來自單一可(kě)再生來源,從而限制了開發标準化的“現成”細胞的潛力。人類胚胎幹細胞(hESC-NK)和人誘導多(duō)能(néng)幹細胞(hiPSC-NK)的NK細胞已被證明具(jù)有(yǒu)與原代細胞相似的表型和功能(néng),更為(wèi)同質(zhì),可(kě)以在克隆水平上進行基因修飾,并且易于擴展到臨床規模,是目前最有(yǒu)前景的發展成标準化過繼性NK細胞的理(lǐ)想細胞來源。
2.NK細胞過繼治療的概述
迄今為(wèi)止的臨床試驗表明,NK細胞具(jù)有(yǒu)有(yǒu)效的抗急性髓系白血病(AML)作(zuò)用(yòng),且不引起嚴重的不良反應。在早期臨床試驗中(zhōng),細胞因子(通常為(wèi)IL-2或IL-15)刺激後的自體(tǐ)NK細胞被用(yòng)于腫瘤治療。由于NK細胞的抗腫瘤活性通常被自身人類白細胞抗原(HLA)分(fēn)子所抑制,因此使用(yòng)自體(tǐ)NK細胞的臨床療效有(yǒu)限。随後,利用(yòng)HLA單倍體(tǐ)供體(tǐ)的同種異體(tǐ)NK細胞來阻止NK細胞活性的自我抑制。一項使用(yòng)同種異體(tǐ)PB-NK的試點試驗表明,約30%的難治性或複發性AML患者可(kě)以完全緩解。除AML外,異基因NK細胞療法還被用(yòng)于治療各種實體(tǐ)瘤,如肝細胞癌、肺癌、卵巢癌、乳腺癌、腎細胞癌和大腸癌。
3.使用(yòng)NK細胞治療的臨床試驗
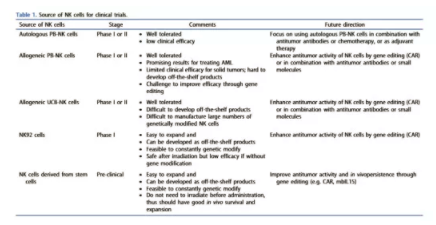
來自不同來源的NK細胞已用(yòng)于過繼性NK細胞臨床試驗(表 1),包括PB-NK細胞(自體(tǐ)和同種異體(tǐ)細胞)、臍帶血分(fēn)離的NK細胞(UCB-NK)和NK細胞系NK-92。使用(yòng)PB-NK和UCB-NK的主要局限性在于,它們非常依賴于供體(tǐ),而不是來自單一的可(kě)再生來源,因此很(hěn)難生成标準化的“現成”細胞免疫治療産(chǎn)品,并且難以開發多(duō)劑量治療。同種異體(tǐ)NK細胞在過繼轉移環境中(zhōng)通常隻存活數周,需要多(duō)劑量。此外,原代NK細胞一般很(hěn)難進行基因修飾。NK-92是來源于NHL患者的人NK細胞系。它們具(jù)有(yǒu)良好的特征、同質(zhì)性、易于基因修飾、無限制的NK細胞來源,這些都是現成的NK細胞治療産(chǎn)品的誘人特性。一些研究用(yòng)不同的CARS或CD16設計了NK-92細胞,以增加血液學(xué)和實體(tǐ)惡性腫瘤的細胞毒性。然而,由于擔心緻瘤性,在給藥前需要對NK-92細胞進行照射,從而限制了這些細胞的抗腫瘤活性。
4.從幹細胞中(zhōng)産(chǎn)生人NK細胞
與原代NK細胞和NK細胞系相比,使用(yòng)hESCs(hESC-NK)或hiPSCs(hiPSC-NK)衍生的NK細胞有(yǒu)幾大優點。首先,hESC-NK / hiPSC-NK細胞是同質(zhì)的、可(kě)重複的,具(jù)有(yǒu)無限的NK細胞來源,可(kě)以開發多(duō)劑量治療方案,消除了供體(tǐ)與供體(tǐ)之間的變異性,以及使用(yòng)PB-NK或UCB-NK細胞時限制細胞數的問題。其次,利用(yòng)慢病毒、轉座子或CRISPR-Cas9系統等多(duō)種基因修飾技(jì )術對幹細胞進行修飾,然後将NK細胞與基因修飾的幹細胞進行區(qū)分(fēn),從而提高抗腫瘤活性或體(tǐ)内持久性。使用(yòng)hiPSC-NK細胞治療腫瘤的臨床試驗正在研究性新(xīn)藥(IND)應用(yòng)中(zhōng)。
5.NK細胞過繼免疫治療面臨的挑戰
盡管人們對使用(yòng)過繼性NK細胞療法治療腫瘤的興趣越來越大,但在人類試驗中(zhōng)的療效有(yǒu)限,尤其是實體(tǐ)腫瘤。主要原因之一是過繼轉移的原代NK細胞或照射的NK-92細胞在體(tǐ)内的持久性較低,從而限制了其抗腫瘤功效。此外,腫瘤微環境可(kě)通過多(duō)種不同的機制導緻NK細胞衰竭和功能(néng)障礙。例如,腫瘤細胞在腫瘤微環境中(zhōng)産(chǎn)生的許多(duō)免疫抑制性細胞因子和代謝(xiè)産(chǎn)物(wù)(如TGF-β、前列腺素E2、吲哚胺2,3-二加氧酶和腺苷)可(kě)以抑制NK細胞的增殖和功能(néng)。此外,腫瘤微環境中(zhōng)含有(yǒu)豐富的其他(tā)宿主免疫細胞(如骨髓源性抑制細胞和調節性T細胞),這些細胞可(kě)被IL-2激活以抑制NK細胞功能(néng)并限制其抗腫瘤活性。最後,未經基因修飾的NK細胞對某些腫瘤靶點(如B細胞淋巴瘤和絨毛膜癌細胞)具(jù)有(yǒu)低或無細胞毒性,可(kě)能(néng)是由于缺乏NK細胞激活受體(tǐ)的配體(tǐ)和抑制配體(tǐ)的高表達。此外,在與腫瘤細胞相互作(zuò)用(yòng)後,激活受體(tǐ)(如NKG2D、NKp30、NKp46或DNAM-1)在NK細胞上表現為(wèi)下調。因此,改善NK細胞的體(tǐ)内持久性,克服免疫抑制性腫瘤微環境,通過基因修飾增強抗腫瘤細胞毒性,對于提高NK細胞的抗腫瘤活性和開發下一代過繼NK細胞治療産(chǎn)品是非常可(kě)取的。然而,如前所述,目前臨床試驗中(zhōng)使用(yòng)的NK細胞要麽很(hěn)難進行基因修飾(原代NK細胞),要麽需在給患者注射前進行照射(NK-92細胞)。相比之下,hESC/iPSC-衍生的NK細胞由于其同質(zhì)化和基因工(gōng)程改善抗腫瘤功能(néng)的可(kě)行性,是開發标準化的“現成”免疫治療産(chǎn)品的理(lǐ)想細胞群(圖1)。
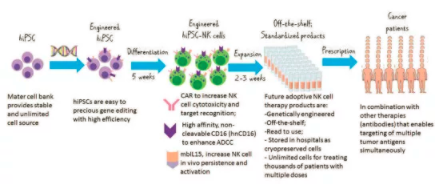
圖 1. 下一代過繼性NK細胞治療産(chǎn)品的開發
來自健康捐贈者的體(tǐ)細胞的HIPSC作(zuò)為(wèi)主細胞庫儲存,以提供一緻和無限的起始細胞群。hiPSC是在一個克隆水平上利用(yòng)各種技(jì )術(如CRISPR)精(jīng)确地進行基因工(gōng)程,并進行分(fēn)化,生産(chǎn)hiPSC-NK細胞需要大約5周的時間。目前正在探索的幾種改善NK細胞抗腫瘤功能(néng)的策略,包括配備NK細胞CAR以增加細胞毒性和靶點識别,hNCD16以增強ADCC,以及MBIL15以增加體(tǐ)内持久性和活化。這些策略在臨床前異種移植小(xiǎo)鼠模型中(zhōng)顯示了陽性結果,為(wèi)臨床試驗提供了保證。在擴增2-3周後,即可(kě)獲得現成的臨床規模。細胞以冷凍保存的形式儲存,可(kě)生成多(duō)劑量,用(yòng)于治療成千上萬的患者。HiPSC-NK細胞可(kě)與其他(tā)療法結合使用(yòng),尤其是現成的抗腫瘤抗體(tǐ),使多(duō)個腫瘤抗原的靶向同時具(jù)有(yǒu)驅動機制,旨在最終治愈腫瘤。
6.提高hiPSC-NK細胞體(tǐ)内持久性的策略
細胞因子如IL-2和IL-15是參與NK細胞功能(néng)的關鍵分(fēn)子,包括分(fēn)化、增殖、活化和存活。IL-2已廣泛應用(yòng)于體(tǐ)外擴增NK細胞和延長(cháng)患者注入的NK細胞存活率。然而,白細胞介素-2可(kě)在患者中(zhōng)引起嚴重的副作(zuò)用(yòng)(如毛細血管滲漏綜合征)。IL-2還激活Treg細胞,從而抑制NK細胞功能(néng),降低其抗腫瘤作(zuò)用(yòng)。與IL-2相似,IL-15已被證明可(kě)刺激NK細胞的增殖,IL-15水平與患者輸注NK細胞的體(tǐ)内擴增相關。在非人類靈長(cháng)類動物(wù)中(zhōng),IL-15刺激了NK細胞的擴展,但不産(chǎn)生明顯的毒性。據報道,IL-15在體(tǐ)外也能(néng)增加NK細胞的活化受體(tǐ)NKP30的表達,從而改善了NK細胞的細胞毒性。因此,IL-15與IL-2比較,臨床上有(yǒu)許多(duō)IL-15産(chǎn)物(wù)的開發,包括IL-15超激動劑(ALT 803)。患者對ALT-803有(yǒu)良好的耐受性,能(néng)夠在體(tǐ)内促進CD8+T和NK細胞的擴增,而不刺激Treg細胞。在生理(lǐ)條件下,血清中(zhōng)的IL-15與IL-15Rα結合形成天然複合物(wù),其表達于二聚體(tǐ)IL-15β(CD122)/γC(CD132)受體(tǐ)(包括NK細胞)的細胞。在與IL-15β和γc亞單位結合後,IL-15激活了Janus激酶1和Janus激酶3,從而導緻信号轉導的磷酸化和激活以及轉錄3(STAT3)和STAT5的激活。
一組研究人員通過将人IL-15基因與編碼的CD8α連接,并将其轉化為(wèi)PB-NK細胞,從而産(chǎn)生了膜結合的IL-15(mbIL15)。研究表明,在沒有(yǒu)外源性細胞因子的情況下,表達mbIL15的人NK細胞在體(tǐ)外和體(tǐ)内的存活和擴增要優于未經修飾的NK細胞或表達非膜結合的IL-15的NK細胞。此外,mbIL15 NK細胞在體(tǐ)外對白血病、淋巴瘤和實體(tǐ)瘤細胞具(jù)有(yǒu)增強的細胞毒性,在異種移植模型中(zhōng)對白血病和肉瘤細胞具(jù)有(yǒu)增強的細胞毒性。最近,另一組通過将IL15和IL15Rα與Ser-Gly連接物(wù)融合,并使用(yòng)“睡美人”轉座系統在T細胞中(zhōng)與第二代CAR共表達,創造了不同的mbIL15。mbIL15-CAR T細胞在白血病異種移植模型中(zhōng)表現出改善的持久性和抗腫瘤作(zuò)用(yòng)。
另一種增強NK細胞中(zhōng)細胞因子信号的方法是調控細胞因子信号的負調節。 細胞因子信号轉導(SOCS)蛋白(CIS;SOCS1-7)的抑制因子是細胞因子信号傳導的重要負調節因子,CIS是NK細胞介導的腫瘤免疫中(zhōng)一個有(yǒu)效的抑制檢查點,因為(wèi)在小(xiǎo)鼠NK細胞中(zhōng),細胞因子誘導的含SH2蛋白(CISH)的缺失使其對IL-15,增強了對腫瘤的細胞毒性。hiPSC-NK細胞中(zhōng)CISH的缺失表明CIS可(kě)以調節人類NK細胞的抗腫瘤活性。CAR和IL-15信号的結合是一種提高NK細胞抗腫瘤功能(néng)的有(yǒu)效途徑。
7.通過增強ADCC提高hiPSC-NK細胞抗腫瘤細胞毒性
ADCC是一種由NK細胞介導的關鍵效應器機制,能(néng)夠發揮治療性單克隆抗體(tǐ)的抗腫瘤作(zuò)用(yòng)。該過程由CD16a介導,CD16a結合單克隆抗體(tǐ)的Fc部分(fēn),并被金屬蛋白酶ADAM 17切割。CD16a有(yǒu)兩個單核苷酸多(duō)态性(SNP)變體(tǐ),即高Fc親和力的FcγRIIIA158V和低親和力的FcγRIIIA158F。當用(yòng)西妥昔單抗、曲妥珠單抗或利妥昔單抗治療時,CD16a高親和力的SNP患者比低親和力的SNP患者有(yǒu)更高的客觀反應性和無進展生存率。一項初步研究确定了CD16a的ADAM 17裂解位點,并通過突變該裂解位點,創造了一個高親和力CD16a(hnCD16)的不可(kě)折疊版本。用(yòng)hnCD16設計的hiPSC-NK細胞已顯示出穩定的CD16a表達,并對刺激後的激活誘導脫落具(jù)有(yǒu)抵抗力,因此在體(tǐ)外和異種移植小(xiǎo)鼠模型中(zhōng)對各種腫瘤靶點顯示出增強的ADCC效應。hnCD16設計的hiPSC-NK細胞的好處在于,經修飾的NK細胞可(kě)以與任何可(kě)用(yòng)的抗腫瘤抗體(tǐ)結合,并普遍針對不同的腫瘤,而無需使用(yòng)針對每個腫瘤抗原的CARs對其進行修飾。
8.表達CAR的hiPSC-NK細胞
最近研究了不同來源的NK細胞(如Pb-NK、UCB-NK和NK92細胞)上的CARs,以指導抗腫瘤活性。針對一系列抗原(包括CD19、CD20、ErbB2(HER2)、CD38、EGFR、GD2等)的CAR工(gōng)程NK-92細胞在臨床前體(tǐ)内模型中(zhōng)顯示出有(yǒu)希望的結果。此外,用(yòng)CAR-CD19、IL-15和可(kě)誘導caspase-9(iC9)自殺基因設計的UCB-NK細胞在Raji淋巴瘤小(xiǎo)鼠模型中(zhōng)顯示出改善的持久性和抗腫瘤活性。
最近報道了用(yòng)一種新(xīn)的CAR(包含NKG2D的跨膜結構域、2B4共刺激結構域和介導強抗原特異性NK細胞信号的CD3ζ信号結構域)設計的hiPSC-NK細胞。這種CAR(稱為(wèi)NK-CAR)是專門為(wèi)增強針對間皮素表達腫瘤的NK細胞活性而設計的。在卵巢癌異種移植模型中(zhōng),與PB-NK細胞、未修飾的iPSC-NK細胞或表達T CAR的細胞iPSC-NK(CD28-41BBζ)相比,NK-CAR表達的iPSC -NK細胞顯著抑制腫瘤生長(cháng)并延長(cháng)生存期。有(yǒu)趣的是,在同一個體(tǐ)内模型中(zhōng),在腹腔注射10天後,表達NK-car的iPSC -NK細胞在循環、脾髒和腹膜液中(zhōng)的持久性高于PB-NK細胞和iPSC -NK細胞。此外,在卵巢癌異種移植模型中(zhōng),第三代CAR-表達 T細胞與CAR-表達 NK細胞的比較表明,CAR-表達NK細胞比CAR-表達 T細胞更安(ān)全地發揮抗腫瘤作(zuò)用(yòng)。
“論腫道麻”點評
細胞過繼免疫療法的最新(xīn)進展使腫瘤治療發生了革命性的變化。為(wèi)了提高NK細胞的抗腫瘤活性,目前的臨床試驗要麽将NK細胞與抗體(tǐ)結合起來增強ADCC,要麽使用(yòng)基因修飾的NK細胞(如NK-CAR)(表1)。來源于人類幹細胞源性的NK細胞為(wèi)過繼免疫治療提供了一個平台,可(kě)以生産(chǎn)出統一的、一緻的、現成的、臨床規模的、具(jù)有(yǒu)改進活性的基因工(gōng)程NK細胞。盡管有(yǒu)希望,但人類幹細胞源性NK細胞的應用(yòng)仍存在一些挑戰。首先,與同種異體(tǐ)PB-NK或UCB-NK細胞一樣,由于被受體(tǐ)的T細胞拒絕識别不匹配的MHC,來自HLA不匹配供體(tǐ)的未經修飾的iPSC- NK細胞在患者中(zhōng)的持久性較低。因此,多(duō)劑量和基因修飾以增加iPSC -NK細胞的持久性是非常需要的。其次,盡管迄今為(wèi)止大多(duō)數臨床試驗表明,自體(tǐ)或同種異體(tǐ)NK細胞是安(ān)全的,但随着iPSC -NK細胞的生存率和抗腫瘤活性的提高,NK細胞治療(如CRS)可(kě)能(néng)發生潛在細胞毒性,最終可(kě)能(néng)導緻幹細胞向NK細胞分(fēn)化過程的基因不能(néng)在iPSC -NK細胞中(zhōng)被修飾。随着通過基因編輯提高NK細胞的抗腫瘤活性和體(tǐ)内持久性,并結合CAR-T細胞治療的細胞毒性臨床經驗,NK細胞過繼療法将會逐漸成為(wèi)腫瘤治療的前沿之一。
(編譯 董靜;審校 缪長(cháng)虹)
參考文(wén)獻:
Wang K, Han Y, Cho WC, Zhu H. The rise of human stem cell-derived natural killer cells for cancer immunotherapy. Expert Opin Biol Ther. 2018 Dec 24:1-8. doi: 10.1080/14712598.2019.1559293.
版權聲明
本公(gōng)衆号所有(yǒu)轉載文(wén)章是出于傳遞信息,分(fēn)享熱點的目的,同時明确注明來源和作(zuò)者,不希望被轉載的媒體(tǐ)或個人可(kě)與我們聯系(marketing@Countstar.cn),我們将立即進行删除處理(lǐ)。所有(yǒu)文(wén)章僅代表作(zuò)者觀點,不代表本站立場。


