基于信使 RNA (mRNA) 的疫苗在 COVID-19 大流行期間獲得了人們的認可(kě)。
這種傳統疫苗的新(xīn)型替代品之所以出現,有(yǒu)幾個原因:一方面,mRNA疫苗僅編碼一種特定抗原,體(tǐ)内半衰期可(kě)控,屬于非插入性和非傳染性的技(jì )術,使用(yòng)非常安(ān)全[1]。另一方面,與基于細胞的生物(wù)制藥生産(chǎn)相比,mRNA 的生産(chǎn)快速且易于擴展,具(jù)有(yǒu)較高的生産(chǎn)效率。mRNA疫苗的生産(chǎn)包括一系列工(gōng)藝步驟,從生物(wù)反應器中(zhōng)的生産(chǎn)到随後的多(duō)步驟的純化和配制。
然而,mRNA 療法是一項新(xīn)技(jì )術,相關技(jì )術平台在不斷發展,工(gōng)藝參數也在迅速變化[2]。Lucullus® 工(gōng)藝過程信息管理(lǐ)軟件是監控過程參數、記錄工(gōng)藝過程數據,從研發實驗室到生産(chǎn),從上遊到下遊中(zhōng)控制 mRNA 制造過程中(zhōng)所有(yǒu)步驟的過程控制的理(lǐ)想解決方案。
Lucullus® 的獨立于供應商(shāng)的整合能(néng)力和模塊化架構為(wèi)整合來自不同制造商(shāng)和不同數據接口的設備提供了必要的靈活性。工(gōng)藝流程的調整、實驗的自動化和遠(yuǎn)程控制、培養基和緩沖液配方管理(lǐ)、樣品管理(lǐ)都可(kě)以通過單一軟件實現,同時它也符合GMP生産(chǎn)規範以及可(kě)以滿足客戶定制化需求。
mRNA疫苗
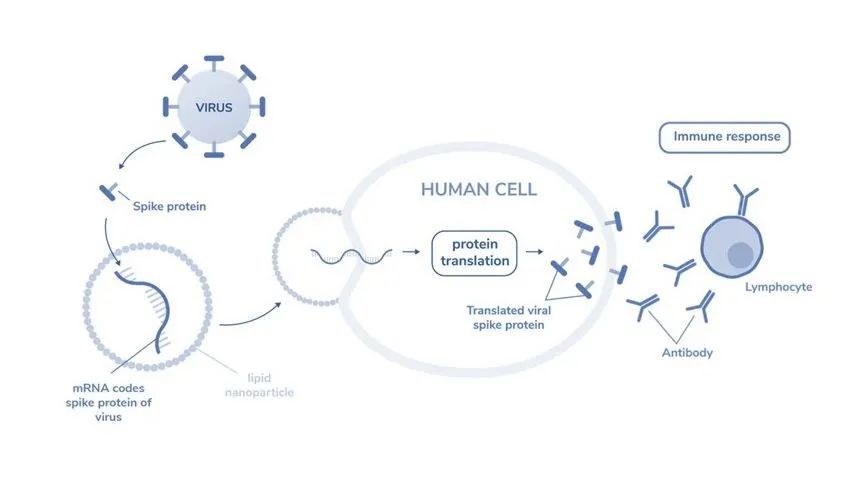
mRNA 疫苗基于類似的原理(lǐ)開發,不同于将滅活病毒或病毒蛋白引入體(tǐ)内, mRNA技(jì )術将一段mRNA引入體(tǐ)内,并根據指令産(chǎn)生特定的病毒抗原。為(wèi)了有(yǒu)效地将 mRNA 分(fēn)子遞送到細胞質(zhì)中(zhōng),需要使用(yòng) mRNA 遞送系統,包括病毒遞送系統、基于脂質(zhì)的載體(tǐ)、(陽離子)聚合物(wù)和多(duō)肽[3]。将 mRNA 遞送到細胞的胞質(zhì)中(zhōng)可(kě)能(néng)會觸發靶蛋白的産(chǎn)生,該靶蛋白可(kě)以起到治療或預防的作(zuò)用(yòng),作(zuò)為(wèi)抗原觸發用(yòng)于疫苗接種目的的免疫反應,替換有(yǒu)缺陷的蛋白質(zhì),或觸發抗腫瘤反應。因此,mRNA 疫苗還具(jù)有(yǒu)預防其他(tā)感染和治療包括癌症、艾滋病毒、流感甚至遺傳疾病在内的多(duō)種疾病的潛力[4]。
圖1:mRNA編碼病毒的刺突蛋白
與其他(tā)遞送系統相比,腺相關病毒 (AAV) 等病毒遞送系統已得到很(hěn)好的研究并被批準作(zuò)為(wèi)疫苗和基因治療的載體(tǐ)。病毒遞送系統可(kě)能(néng)導緻免疫原性和更頻繁的全身副作(zuò)用(yòng)[5]。此外,其制造過程要複雜得多(duō),基因治療領域的應用(yòng)需要更高的滴度。相比之下,為(wèi)mRNA 生産(chǎn)過程中(zhōng)創建穩健的生産(chǎn)規模平台較為(wèi)容易。公(gōng)司一旦知道病原體(tǐ)的基因序列,就可(kě)以相對快速地設計出 mRNA 疫苗,從而可(kě)以專注于工(gōng)藝開發。COVID-19 疫苗可(kě)能(néng)隻是 mRNA 革命的開始。
mRNA制造過程
mRNA 疫苗的大規模生産(chǎn)包括一個或兩個步驟的體(tǐ)外反應,然後通過多(duō)個步驟進行純化,其中(zhōng)可(kě)能(néng)包括 DNase 消化、沉澱、層析或切向流過濾。
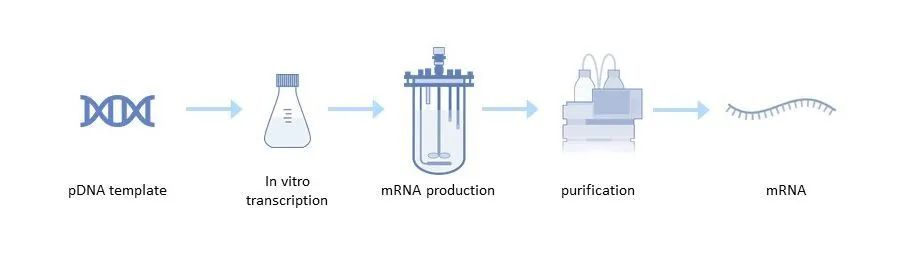
pDNA模闆的生産(chǎn)
需要線(xiàn)性化以避免可(kě)能(néng)産(chǎn)生不希望的 mRNA 的轉錄事件。它是通過在反應緩沖液中(zhōng)将質(zhì)粒 DNA 與限制性内切酶混合來實現的 [1]。然後通過切向流過濾 (TFF) 或色譜法去除限制性酶、BSA、DNA 片段、内毒素等雜質(zhì)。
體(tǐ)外轉錄
下一步是體(tǐ)外轉錄,其中(zhōng)作(zuò)為(wèi) DNA 模闆的線(xiàn)性pDNA 被轉錄成 mRNA。這種酶促反應使用(yòng)自然轉錄過程的元素,包括 RNA 聚合酶和核苷酸三磷酸。轉錄後,最終的 mRNA 結構需要一個 5' 帽結構才能(néng)在細胞中(zhōng)穩定且有(yǒu)效地翻譯[4]。
mDNA純化
在體(tǐ)外轉錄步驟之後,需要進一步純化 mRNA,包括内毒素、免疫原性雙鏈 RNA (dsRNA)、DNA 模闆殘基、RNA 聚合酶和元素雜質(zhì)。有(yǒu)幾種方法可(kě)用(yòng)于 mRNA 純化,例如 TFF 或色譜步驟,包括反相離子對、陰離子交換和帶有(yǒu)聚 (dT) 分(fēn)離的親和色譜 [5]。
純化後,進行最終濃縮和滲濾以最大限度地提高産(chǎn)品純度,并将 mRNA 轉移到适當的緩沖液中(zhōng)進行制劑或儲存。
圖2:mRNA生産(chǎn)過程
脂質(zhì)納米顆粒 (LNP)
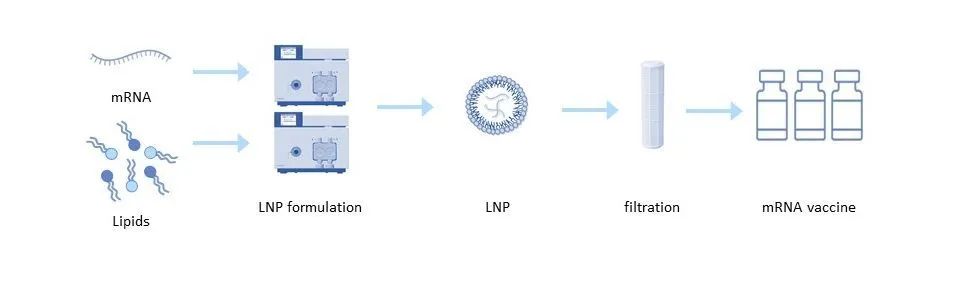
遞送工(gōng)具(jù)對于 mRNA 疫苗和治療的有(yǒu)效性同樣重要。脂質(zhì)納米顆粒 (LNP) 最常用(yòng)于 mRNA 遞送。每個脂質(zhì)納米顆粒由四種不同的脂質(zhì)組成,它們允許 mRNA 在内部運輸并防止其降解。這些脂質(zhì)還負責将 RNA 有(yǒu)效釋放到細胞質(zhì)中(zhōng)。陽離子脂質(zhì)的結構對LNP的活性、毒性和生物(wù)分(fēn)布有(yǒu)很(hěn)大影響,進而影響體(tǐ)内潛在的毒性作(zuò)用(yòng)[6]。為(wèi)了在最終配方中(zhōng)獲得可(kě)重複的結果,需要一緻的脂質(zhì)質(zhì)量,這取決于用(yòng)于合成脂質(zhì)的原材料的質(zhì)量和脂質(zhì)本身的相應材料特性。
圖 3:脂質(zhì)納米顆粒配方
可(kě)以使用(yòng)多(duō)種技(jì )術将純化的 mRNA 配制成遞送顆粒。在普通溶劑注射技(jì )術中(zhōng),脂質(zhì)溶解在溶劑如乙醇中(zhōng),并在含有(yǒu) mRNA 的低 pH 水性緩沖液中(zhōng)快速混合。然後将低 pH 緩沖液滲濾到中(zhōng)性緩沖液中(zhōng),再通過超濾濃縮顆粒 [5]。
使用(yòng) Lucullus® 進行工(gōng)藝過程監控
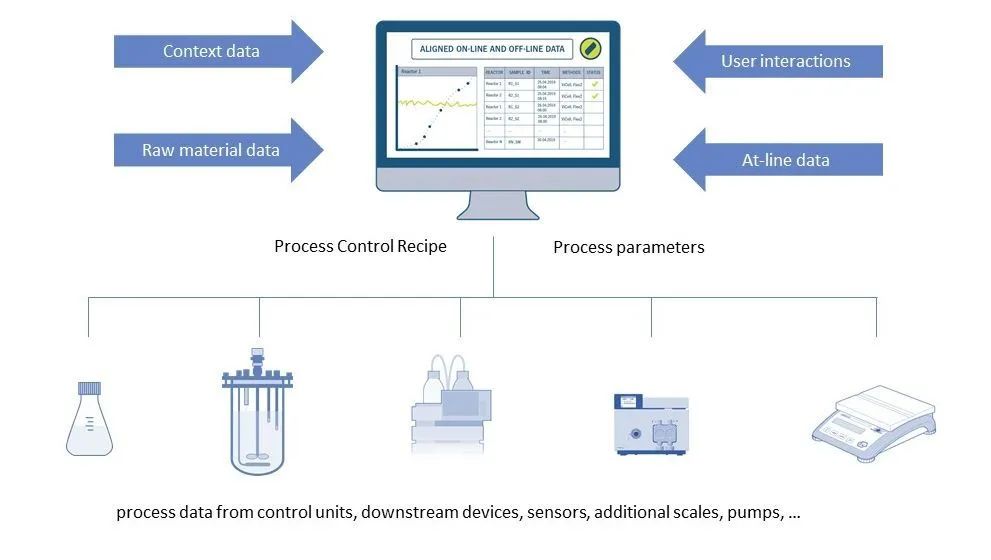
不同的設備用(yòng)于上述各個工(gōng)藝步驟。從簡單的傳感器、秤和泵到複雜的生物(wù)反應器控制系統和色譜系統。這些設備通常來自不同的制造商(shāng)。同時不同型号的設備增加了安(ān)裝(zhuāng)的複雜性。許多(duō)公(gōng)司的目标是收集每個工(gōng)藝步驟中(zhōng)所有(yǒu)設備的數據,并将其存儲在單個數據庫中(zhōng)以進行監控和審查。在某些操作(zuò)單元(例如,上遊生物(wù)反應器、LNP 制劑),公(gōng)司還希望實現自動化和遠(yuǎn)程控制過程。由于該軟件需要在 GMP 環境中(zhōng)運行的,因此公(gōng)司必須根據需要的文(wén)件執行必要的 IQ/OQ 測試。Lucullus® 工(gōng)藝過程信息管理(lǐ)系統(Securecell AG,瑞士),其第一個版本于 1995 年發布,是用(yòng)于生物(wù)過程管理(lǐ)和控制的全面而強大的中(zhōng)央數據中(zhōng)心。Lucullus® 提供了一個統一的、靈活的和對科(kē)學(xué)家友好的 SCADA 功能(néng)。它被設計為(wèi)一個集中(zhōng)的數據采集、監控和控制平台,用(yòng)于上遊和下遊開發,以協調和控制各個設備之間的交互活動。
圖 4:Lucullus® 流程信息管理(lǐ)軟件
Lucullus 的設備獨立性和模塊化架構提供了集成來自不同制造商(shāng)和不同數據接口的設備以及執行所有(yǒu)過程自動化任務(wù)的靈活性。在線(xiàn)設備數據(來自工(gōng)藝過程單元)與來自在線(xiàn)或離線(xiàn)分(fēn)析的基于樣本的結果融合,也可(kě)用(yòng)于過程控制。内置培養基管理(lǐ)可(kě)實現儲配液間活動(緩沖液、補料、培養基)的數字化,同時提供清晰的工(gōng)作(zuò)流程,将培養基制備記錄鏈接到工(gōng)藝單元,以實現原材料和工(gōng)藝結果的可(kě)追溯性。結合Securecells 的 PAT 系統,即 Numera®自動取樣與樣品處理(lǐ)系統,Lucullus® 涵蓋了工(gōng)藝過程的取樣計劃、實時取樣和在線(xiàn)和離線(xiàn)分(fēn)析儀器的數據處理(lǐ)。Securecell 推出的 Lucullus® 工(gōng)藝過程信息管理(lǐ)軟件結合生物(wù)工(gōng)藝數字化的最新(xīn)科(kē)技(jì )為(wèi)mRNA 疫苗開發和生産(chǎn)領域的客戶提供強大且靈活的解決方案。
References
[1].Pardi, N., Hogan, M., Porter, F. et al. mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov 17, 261–279 (2018). https://doi.org/10.1038/nrd.2017.243
[2].Sartorius AG. The Next Generation of Vaccines Therapies – mRNA Vaccines. www.sartorius.com, 2022. [Internet]
[3].Rosa SS, Prazeres DMF, Azevedo AM, Marques MPC. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15;39(16):2190-2200. doi: 10.1016/j.vaccine.2021.03.038.
[4].Sara Sousa Rosa, Duarte M.F. Prazeres, Ana M. Azevedo, and Marco P.C. Marques. mRNA vaccines manufacturing: Challenges and bottlenecks. Vaccine. 2021 Apr 15; 39(16): 2190–2200
[5].Laurens Vergauwen, Dr. Nargisse El Hajjami, Mag. Manuel Brantner, Dr. Shiksha Mantri and Bahar Cebi. Manufacturing Strategies for mRNA Vaccines and Therapeutics. BioProcess Online. [Internet]
[6].Bancel S, Issa J, Aunins J. Ribonucleic acid purification (Patent No. WO2014152031A1). [Internet]