審計追蹤功能(néng)越來越受到監管部門和企業重視。生物(wù)及制藥企業對審計追蹤的首要且最終目的是為(wèi)了确保電(diàn)子記錄的真實性。審計追蹤成為(wèi)監管和行業發展的大趨勢,進而對涉及企業的生産(chǎn)、質(zhì)量、物(wù)料等各部門數據的完整性提供可(kě)溯源的證據。
審計追蹤
審計追蹤:是一系列有(yǒu)關計算機操作(zuò)系統、應用(yòng)程序及用(yòng)戶操作(zuò)等事件的記錄,用(yòng)以幫助我們從原始數據追蹤到有(yǒu)關的記錄、報告或事件,或從記錄、報告、事件追溯到原始數據。——中(zhōng)國(guó)GMP附錄(2015):計算機化系統 第六章 術語
審計跟蹤是用(yòng)來呈現系統中(zhōng)“誰、何時、做什麽、為(wèi)什麽這樣做”的記錄,能(néng)夠重現與電(diàn)子記錄的創建、修改或删除有(yǒu)關的事件過程。通過審核審計追蹤,可(kě)以知道測試數據的産(chǎn)生是否真實、有(yǒu)效,是否符合數據完整性的要求。
審計追蹤的法規依據
2.1 美國(guó)聯邦法規21章 第11款 (21 CFR Part 11) 中(zhōng)的11.10 (e)部分(fēn)
使用(yòng)審計追蹤(獨立地)記錄操作(zuò)者登錄和操作(zuò)(包括電(diàn)子記錄的創建、修改或删除)的日期和時間,該審計追蹤記錄應該是安(ān)全的、計算機自動生産(chǎn)的,自帶時間标記的。審計追蹤産(chǎn)生的新(xīn)記錄不能(néng)覆蓋之前的記錄信息。審計追蹤記錄應該與其所歸屬的記錄的保存期一緻;此外,當FDA需要審核和拷貝時,審計追蹤文(wén)件應該是可(kě)用(yòng)的。
2.2 歐盟GMP附件11 中(zhōng)的審計追蹤部分(fēn)
基于風險評估,應該考慮在系統内部創建所有(yǒu)和GMP數據相關的創建、變更和删除記錄(就是在系統内部産(chǎn)生審計追蹤)。對于變更或者删除GMP相關的數據,應該記錄原因。應該具(jù)有(yǒu)審計追蹤功能(néng),并且可(kě)以轉化為(wèi)一般意義上易于理(lǐ)解的形式,便于定期審核。
此外,MHRA的《GXP數據完整性指南和定義》,WHO的《數據完整性指南》以及其他(tā)與數據完整性相關的法規指南都有(yǒu)與上述法規相類似的審計追蹤要求。
審計追蹤的作(zuò)用(yòng)
審計追蹤是按操作(zuò)人員自始至終的操作(zuò)途徑、順序,檢查、審查和檢驗每個操作(zuò)及活動,管理(lǐ)員可(kě)監測操作(zuò)人員的操作(zuò)是否規範,是否有(yǒu)篡改數據的嫌疑。同時,若發現問題及偏差,也可(kě)通過審計追蹤來查明此次偏差事故時怎麽發生、何時發生、什麽地方出現問題以及為(wèi)什麽會發生。這也可(kě)以幫助管理(lǐ)層來确定是誰的責任,是操作(zuò)人員還是軟件系統或其他(tā)原因。從操作(zuò)人員考慮,操作(zuò)人員知道自己的操作(zuò)都将被記錄在審計日志(zhì)中(zhōng),那麽他(tā)将會自覺得根據SOP來進行規範操作(zuò),減小(xiǎo)差錯發生的概率,從而降低引起電(diàn)子記錄出現差錯的人為(wèi)風險。
Rigel/Altair的審計追蹤
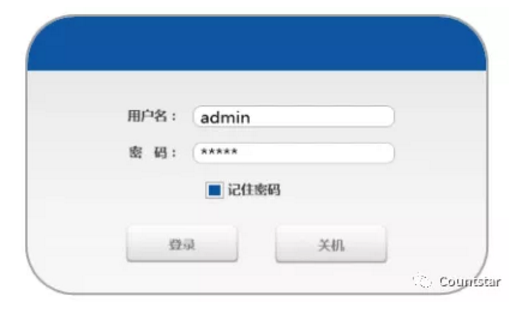
圖一 登錄窗口
隻有(yǒu)被授權的人才能(néng)使用(yòng)Countstar儀器

圖二 電(diàn)子記錄
Countstar軟件可(kě)對任何修改,編輯,删除,調節等做出詳細的記錄,且記錄在此機器上的任何操作(zuò),可(kě)導出隻讀的PDF報告。同時電(diàn)子記錄不可(kě)被删除,修改,可(kě)以按關鍵字或者時間進行檢索。
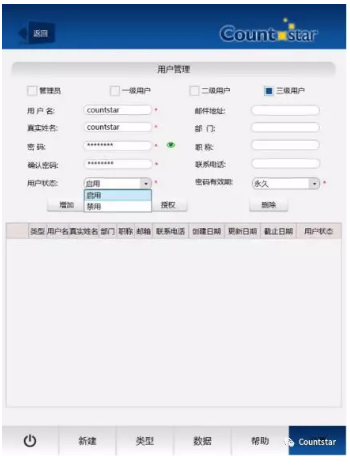
圖三 用(yòng)戶管理(lǐ)權限
Countstar軟件有(yǒu)三級用(yòng)戶管理(lǐ)權限,可(kě)對不同層級的用(yòng)戶進行授權。被授權的用(yòng)戶可(kě)以操作(zuò)Countstar軟件,使用(yòng)預設好的程序進行,所有(yǒu)操作(zuò)步驟都是來源确定的。數據庫中(zhōng)的每一條記錄均有(yǒu)操作(zuò)者的信息,包括真正姓名(míng),部門,郵箱,聯系方式等。

(PS: 僅限于研究用(yòng)途, 不可(kě)用(yòng)于診斷操作(zuò))


