癌症是典型的多(duō)細胞增殖失控性疾病。一般認為(wèi),地球生命在6億年前出現多(duō)細胞生命,現存的海綿類多(duō)孔動物(wù)門是最早出現的多(duō)細胞動物(wù)。人類的疾病多(duō)少與先天發育不足有(yǒu)關,另外一些與後天的損傷有(yǒu)關。人體(tǐ)内的主要系統隻有(yǒu)2種:代謝(xiè)和免疫,所有(yǒu)的疾病不外此2種。
1億年前,鼠與人類的共同祖先出現。

人與人之間的基因組相似度在99.99%。我們血緣關系最近的親屬——黑猩猩,在基因上與我們人類的相似度達到了96%。人類和猕猴共有(yǒu)93%的DNA。貓的基因與我們人類有(yǒu)着90%的相似性。
當涉及到蛋白編碼基因時,老鼠與我們有(yǒu)着85%的相似度,但是在非編碼基因上,隻有(yǒu)大約50%的相似度。國(guó)家人類基因研究所把這種相似性歸咎于大約8千萬年前的共同祖先。幾乎所有(yǒu)的人類基因在老鼠身上都有(yǒu)個明确的對應基因,但是蛋白質(zhì)編碼基因隻占據了各自基因組的1.5%,基于此,能(néng)治愈老鼠的化合藥物(wù)通常對人類無效。
2009年《科(kē)學(xué)》雜志(zhì)上的一篇報道,家牛與我們人類共享大約80%的基因。雞與人類共享了大約60%的基因。果蠅與人類共享了61%的緻病基因,這對于美國(guó)宇航局探索太空旅行可(kě)能(néng)對人類基因産(chǎn)生的影響非常重要。香蕉也與人類共享了大約60%的基因。
目錄
一、免疫發展史
二、免疫學(xué)原理(lǐ)
三、主要抗癌免疫療法
四、免疫狀态評估
五、免疫治療毒性和療效評估
六、ICIs耐藥現象的解釋
七、臨床應用(yòng)
一、免疫治療簡史
免疫系統是多(duō)細胞動物(wù)特化的一個系統,用(yòng)以維持多(duō)細胞動物(wù)在細胞層面和分(fēn)子層面的穩定性。在單細胞動物(wù)中(zhōng)存在的原始基本機制是多(duō)細胞化後複雜機制的基礎,類如在單細胞動物(wù)中(zhōng)的分(fēn)子系統CRISPR-cas系統就是一個維護單細胞穩定性的免疫機制。

1909年Paul Ehrlich提出免疫監視學(xué)說,認為(wèi)免疫系統可(kě)以遏制腫瘤的發生,免疫功能(néng)異常是腫瘤發生的基本原因之一。
1959年Frank Macfarlane Burnet和Lewis Thomas(曾任MSK院長(cháng))提出了“免疫監視(tumor immune surveillance)”的假說,該假說認為(wèi)免疫系統能(néng)夠識别并清除惡性腫瘤,從而抑制了腫瘤的發生發展。
2002年Gavin P Dunn和RobertD Schreiber等首次提出了腫瘤免疫編輯(Tumor Immunoediting)學(xué)說,系統闡述了癌症和免疫系統之間的三階段關系。
二、抗癌免疫學(xué)的基本原理(lǐ)
100餘年人類對免疫系統的不懈研究,目前已經對該領域的主要問題有(yǒu)了一些粗淺的認識。陳列平教授将人類對抗癌免疫的認識過程總結為(wèi),三大基本問題:有(yǒu)沒有(yǒu)?免疫原性的狀态如何?啓動抗癌免疫的相關因素。即:
(一)人類機體(tǐ)内是否存在清除癌細胞的免疫反應?
答(dá)案是肯定的!
1868年一位叫威廉.布什(WilhelmBusch)的醫(yī)生第一次報道,有(yǒu)意使用(yòng)丹毒感染癌症病人後腫瘤顯著縮小(xiǎo)。1891年,美國(guó)紐約紀念醫(yī)院骨科(kē)醫(yī)師威廉.科(kē)利(WilliamB.Coley,1862~1936)開始以注射細菌進入腫瘤的方法治療癌症,創立“科(kē)利毒素”療法。這種方法療效并不穩定,而且可(kě)能(néng)死于感染;改進後混合加熱過的細菌液變得安(ān)全,經這種方法确實有(yǒu)不少人惡性腫瘤在無藥可(kě)醫(yī)的情況下得到了緩解,甚至是長(cháng)期緩解。曾經一睹被打壓的早期免疫治療探索今天已經得到世人的認可(kě),并以其名(míng)字命名(míng)了免疫界最高獎項為(wèi)威廉.科(kē)利獎。
如細胞因子療法、過繼免疫細胞療法及免疫檢查點抑制劑療法的效果已經被證實,其中(zhōng)有(yǒu)廣泛意義的是ICIs,在多(duō)數癌種均有(yǒu)一定比例的患者獲得療效,和既往的化療及分(fēn)子靶向治療的機理(lǐ)完全不同。
(二)是否存在特異性的抗原以引發清除癌細胞的特異性免疫反應?
癌細胞來源與人體(tǐ)自身細胞,存在抗原,但是經曆了免疫編輯後的癌細胞抗原性較弱,難以有(yǒu)效激發免疫反應。而且在腫瘤微環境局部存在複雜的免疫抑制或免疫逃逸,導緻免疫反應不能(néng)有(yǒu)效完成。
抗原是激發免疫反應的起點,未來這個問題尚需要繼續充分(fēn)研究。比利時的Thierry Boon教授長(cháng)期研究癌細胞抗原問題。對于一個已經進入臨床階段并進展的癌症病竈(原位持續增殖或者可(kě)轉移的),有(yǒu)沒有(yǒu)癌細胞獨有(yǒu)的抗原?進展狀态的病竈存不存在人體(tǐ)細胞在任何時期都沒有(yǒu)表達過的抗原性質(zhì)(免疫原性)的物(wù)質(zhì)?
目前看癌症抗原領域有(yǒu)如下觀點:
癌細胞存在獨有(yǒu)的抗原嗎?還是共享的?例如有(yǒu)些CEA/AFP是人類胎兒時期的蛋白質(zhì),且功能(néng)現在也不清楚。癌變後,這些本來應該沉沒的基因重新(xīn)激活并大量表達。不知道癌細胞是紊亂表達還是功能(néng)性表達。存在癌細胞專有(yǒu)表達的基因嗎?目前看是有(yǒu)的,很(hěn)少,要麽表達少,要麽已經被免疫掉,要麽免疫原性不足。
比利時學(xué)者Thierry Boon長(cháng)期研究抗癌免疫反應的核心問題癌症抗原,他(tā)說癌細胞的抗原性才是主要問題。抗原性不足是當前TME免疫抑制/逃逸的解除隻能(néng)解決部分(fēn)問題的一個重要原因。

BOX:癌症抗原問題:沒有(yǒu)抗原性就沒有(yǒu)免疫反應
抗原本身的因素
異物(wù)性
抗原與機體(tǐ)的種系關系越遠(yuǎn),其差異越大,免疫原性也就越強。
1)異種間的物(wù)質(zhì):病原微生物(wù)、動物(wù)免疫血清對人是良好抗原。
2)同種異體(tǐ)間的物(wù)質(zhì):人紅細胞表面ABO血型抗原系統及同種異體(tǐ)皮膚和器官上的組織相容性抗原。
3)自身抗原:自身物(wù)質(zhì)一般無抗原性。
a:與淋巴細胞從未接觸過的自身物(wù)質(zhì)(如晶狀體(tǐ)蛋白)
b:自身物(wù)質(zhì)理(lǐ)化性狀發生改變(外傷、感染、藥物(wù)、電(diàn)離輻射等)
理(lǐ)化性狀
1)分(fēn)子大小(xiǎo)
一般說來分(fēn)子量越大,抗原性越強。具(jù)有(yǒu)抗原性的物(wù)質(zhì),分(fēn)子量一般在10.0kD以上,個别超過100.0kD,低于4.0kD者一般不具(jù)有(yǒu)抗原性。
2)化學(xué)結構的複雜性,
蛋白質(zhì),芳香族氨基酸為(wèi)主者,尤其是含酪氨酸的蛋白質(zhì),抗原性強,非芳香族氨基酸為(wèi)主者,抗原性較弱。
3)分(fēn)子構象和易接近性
4)物(wù)理(lǐ)狀态,
一般聚合狀态的蛋白質(zhì)較其單體(tǐ)免疫原性強,顆粒性抗原強于可(kě)溶性抗原。
免疫途徑和抗原劑量
具(jù)備上述條件的抗原物(wù)質(zhì)可(kě)因進入機體(tǐ)的途徑和劑量的不同而免疫效果迥異。
人工(gōng)免疫時,多(duō)數抗原是非經口進入(皮内、皮下、肌肉、靜脈、腹腔注射)機體(tǐ)才具(jù)有(yǒu)抗原性。
機體(tǐ)方面的有(yǒu)關因素
1)宿主與抗原來源的種系進化關系
2)宿主的遺傳背景
3)機體(tǐ)的健康和營養狀況
以上幾方面因素在一定程度上是相互制約的。
(三)如何激發抗癌免疫反應?
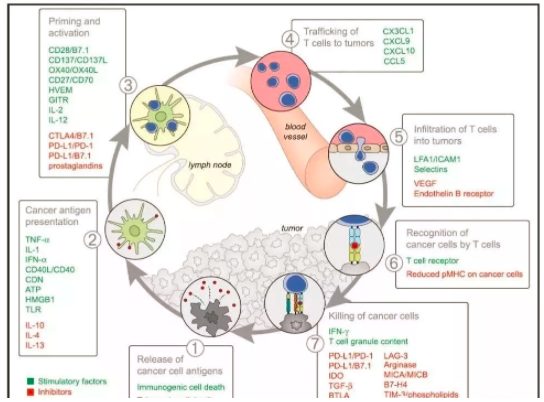
激發免疫反應涉及到很(hěn)多(duō)複雜的方面,如果有(yǒu)時間精(jīng)力也可(kě)以做一個像Daniel Chen的框架圖,就現狀而言,我們仍處在暗室之中(zhōng),隻是偶爾發現了幾個分(fēn)子開關,更加複雜的網絡還沒有(yǒu)被發現。
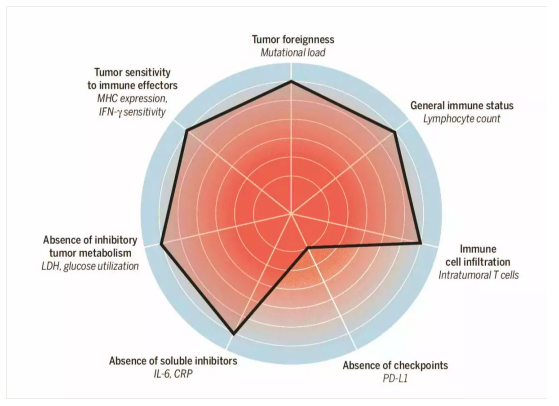
荷蘭Christian U Blank在科(kē)學(xué)雜志(zhì)撰文(wén)描述了影響抗癌免疫反應的7大因素,并用(yòng)雷達圖描繪出來。大概可(kě)分(fēn)類為(wèi)幾類:
① 癌細胞本身的:如有(yǒu)氧酵解水平的LDH,細胞膜表面的抗原負荷、MHC表達,負反饋作(zuò)用(yòng)的PD-L1表達。
② 血液中(zhōng)的:CRP、IL-6所反應的慢性炎症水平;這些标志(zhì)物(wù)反映了人體(tǐ)内有(yǒu)不能(néng)清除的抗原異物(wù)。一如生理(lǐ)性自身免疫反應在于清除體(tǐ)内衰老的廢物(wù)代謝(xiè)物(wù)一樣,使用(yòng)的是IgM快速清除機制,而如果是病理(lǐ)性自身免疫反應就需要動用(yòng)慢性炎症反應機制,IgG系統。還有(yǒu)一個是循環血液中(zhōng)的免疫細胞數,這個反應了宿主的免疫系統狀态。
③微環境中(zhōng)的:TME中(zhōng)的TIL反應了免疫細胞是否能(néng)夠進入最後階段,這一階段停止于局部的免疫抑制或免疫逃逸。
值得注意的是Blank沒有(yǒu)讨論微生态在抗癌免疫中(zhōng)的價值,或許是缺乏可(kě)檢測标準吧。微生态是一個重要的方向,科(kē)學(xué)雜志(zhì)的癌症免疫治療專輯曾專門發文(wén)讨論。
三、主要抗癌免疫療法
抗癌免疫療法的曆史悠久,最早是1868年一位叫威廉.布什(Wilhelm Busch)的醫(yī)生第一次報道,有(yǒu)意使用(yòng)丹毒感染癌症病人後腫瘤顯著縮小(xiǎo)。丹毒(erysipelas)是一種累及真皮淺層淋巴管的感染,主要緻病菌為(wèi)A組β溶血性鏈球菌。誘發因素為(wèi)手術傷口或鼻孔、外耳道、耳垂下方、肛門、陰莖和趾間的裂隙。
1891年,美國(guó)紐約紀念醫(yī)院骨科(kē)醫(yī)師威廉.科(kē)利(William B.Coley,1862~1936)開始以注射細菌進入腫瘤的方法治療癌症,創立“科(kē)利毒素”療法。這種方法療效并不穩定,而且可(kě)能(néng)死于感染;改進後混合加熱過的細菌液變得安(ān)全,經這種方法确實有(yǒu)不少人惡性腫瘤在無藥可(kě)醫(yī)的情況下得到了緩解,甚至是長(cháng)期緩解。
由于20世紀初更加安(ān)全有(yǒu)效的放射療法已經開始普及,科(kē)利毒素療法開始被MSK醫(yī)院禁止,直至後來被ASCO禁止,雖然ASCO最終撤銷了禁令。後來科(kē)利的女兒繼承了父親的遺志(zhì),曾出巨資資助癌症免疫治療研究。曾經一睹被打壓的早期免疫治療探索今天已經得到世人的認可(kě),并以其名(míng)字命名(míng)了免疫界最高獎項為(wèi)威廉.科(kē)利獎。
根據已知的免疫學(xué)原理(lǐ),推測這種利用(yòng)細菌感染治療癌症的機制是以細菌抗原調高機體(tǐ)對腫瘤的反應性,是先天免疫和後天免疫均處于激活狀态。細菌和自身衰老損傷細胞即癌變細胞均為(wèi)同一種免疫機制清除,之間并無嚴格的界限,甚至有(yǒu)相當部分(fēn)功能(néng)處于重疊狀态。
然而由于人類對自身小(xiǎo)宇宙中(zhōng)的這個神秘系統認知的局限性,很(hěn)長(cháng)時間以來人類并沒有(yǒu)找到可(kě)靠的免疫治療方法。直到兩種免疫治療手段出現:
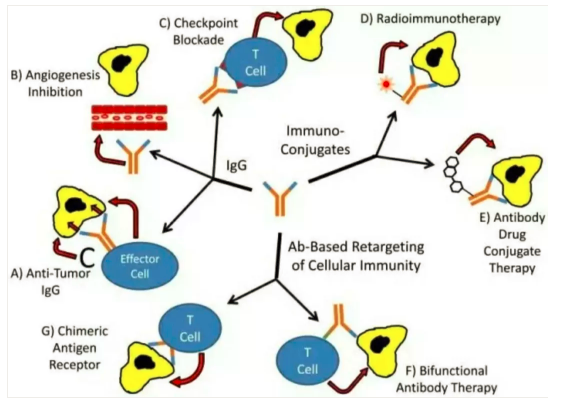
1. 針對癌細胞的抗體(tǐ)治療
癌細胞上有(yǒu)一些特殊的抗原,人類使用(yòng)免疫學(xué)抗體(tǐ)原理(lǐ)清除他(tā)們以達到治療癌症的目的,這些治療取得了一定療效。
赫賽汀單抗:針對癌細胞的生長(cháng)刺激因子,即人類表皮生長(cháng)因子受體(tǐ)2(human epidermal growth factor receptor-2,HER2)。該基因,即c-erbB-2基因,定位于染色體(tǐ)17q12-21.32上,編碼相對分(fēn)子質(zhì)量為(wèi)185000的跨膜受體(tǐ)樣蛋白,具(jù)有(yǒu)酪氨酸激酶活性。這個受體(tǐ)被阻滞後,癌細胞的生長(cháng)轉移特性受到抑制。但是由于癌細胞不止一種生長(cháng)刺激因子,所以即使癌細胞初始表達這種受體(tǐ),但是初始僅有(yǒu)50%左右的病人對這種治療有(yǒu)效,幾乎所有(yǒu)病人會在一年内對該抗體(tǐ)治療耐藥。
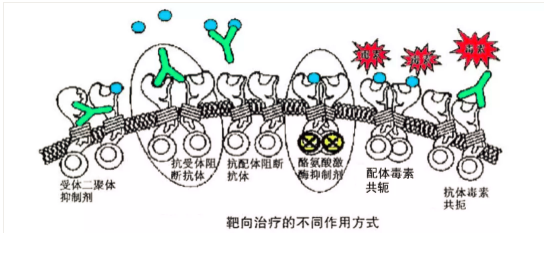
2. 細胞間質(zhì)如血管是癌症病竈必須的,針對癌症病竈中(zhōng)的細胞間質(zhì)治療。
AVASTIN(貝伐單抗):針對VEGF這種細胞因子的抗體(tǐ),可(kě)以引發抗體(tǐ)反應清除這種細胞因子,阻斷體(tǐ)内新(xīn)生血管的形成來阻滞癌症的進展,代價是人體(tǐ)正常的血管新(xīn)生的生理(lǐ)過程也受到幹擾。
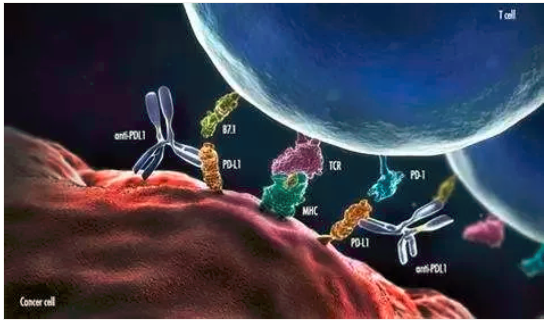
3. 免疫檢測點抑制劑(ICIs)
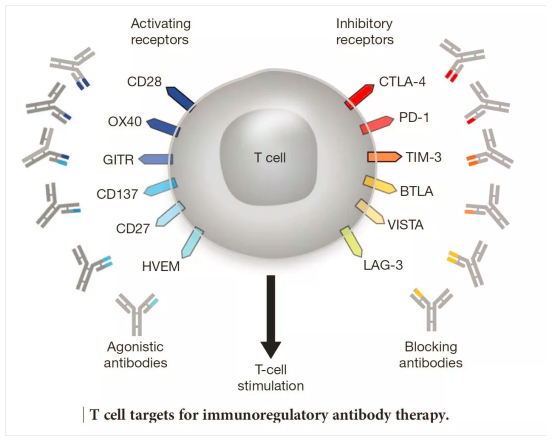
免疫檢測點是指位于效應T細胞上的一些激活性和抑制性受體(tǐ)調節開關,使用(yòng)激活性抗體(tǐ)可(kě)以啓動該受體(tǐ)下遊的功能(néng)(激活或者抑制),激活可(kě)以使得T細胞處于攻擊狀态,抑制可(kě)以使得T細胞處于安(ān)靜狀态。人體(tǐ)内有(yǒu)100萬億個種類各異的真核細胞,如何精(jīng)準地調節T細胞的免疫攻擊性能(néng)是一個受到多(duō)種機制調節的過程,其中(zhōng)免疫檢測點是其中(zhōng)的一種調節機制。
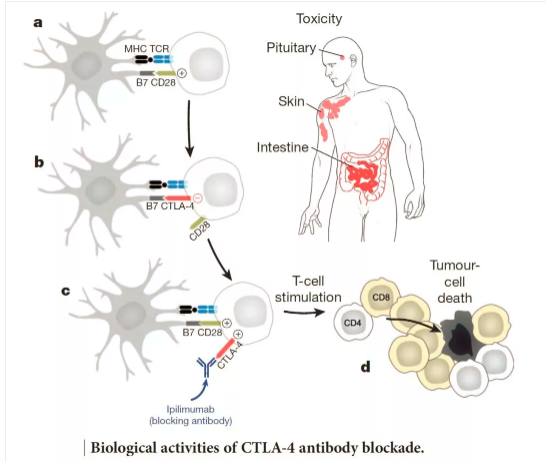
第一個被應用(yòng)于醫(yī)療實踐的免疫檢測點是CTLA-4,由美國(guó)學(xué)者James Allison發現并花(huā)了10年左右證實其功能(néng)。第二個被發現的該類分(fēn)子是PD1/PD-L1,PD1首先被日本學(xué)者本庶佑發現,并被證實其效用(yòng);而PD-L1是被美籍華人學(xué)者陳列平發現的,後也被證實其效用(yòng)。
當前的主要ICIs就是基于這幾個靶點設計的。免疫檢測點由很(hěn)多(duō),其它分(fēn)子也有(yǒu)潛在的開發價值,相關藥物(wù)正在研發中(zhōng)。
4. 過繼細胞療法CAR-T細胞療法
過繼細胞治療經曆了漫長(cháng)的探索過程,早期的過繼細胞治療一般是指:第1代LAK細胞。第2代CIK細胞,第3帶TIL細胞,第4代抗原特異性的CTL細胞。
早期的過繼細胞療法有(yǒu)效率低下,而且制備過程難以标準化評估,已經被基本淘汰。目前流行的是第5代過繼細胞治療法,技(jì )術有(yǒu)2種,除了CAR-T細胞,還有(yǒu)一種叫TCR-T細胞。

四、免疫評估
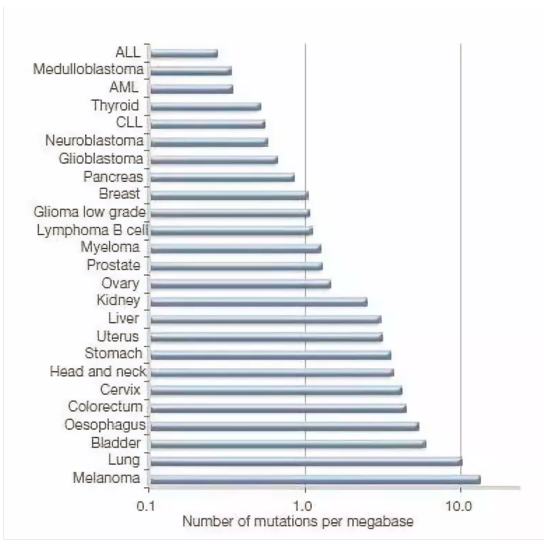
ICIs制劑的療效主要和以下幾個因素相關:
1. 新(xīn)抗原數量:突變負荷是指正常等位基因(A)突變成有(yǒu)害等位基因(a)形成在選擇上不利的純合體(tǐ)(aa)所引起群體(tǐ)适應度下降的現象。如:人類的一些代謝(xiè)遺傳病,象黑尿症、半乳糖血症等。
用(yòng)腫瘤突變負荷(TMB)來定量:被定義為(wèi)每百萬堿基中(zhōng)被檢測出的,體(tǐ)細胞基因編碼錯誤、堿基替換、基因插入或缺失錯誤的總數。具(jù)體(tǐ)操作(zuò)就是測量某種腫瘤體(tǐ)細胞内編碼蛋白的堿基突變數量,包括替換、插入/缺失等各種形式的突變;
量化的描述TMB,可(kě)分(fēn)為(wèi)4類:
1)TMB-High=>20mutations/Mb;
2)TMB-Intermediate, 6-19 Muts/Mb;
3) TMB-Low <= 5 Muts/Mb;
體(tǐ)細胞突變可(kě)能(néng)受到外源性誘變因素的影響,比如肺癌中(zhōng)煙草(cǎo)(吸煙)誘導的C→A的突變。惡性黑色素瘤中(zhōng),紫外線(xiàn)照射引起的C→T的突變。内源性因素引起的突變可(kě)以是DNA錯配修複突變,比如結直腸癌和食管癌中(zhōng)的MSI(微衛星不穩定)。在實體(tǐ)腫瘤中(zhōng),95%的突變為(wèi)單個堿基的替換,造成的非同義突變(一個核苷酸突變改變一個蛋白的氨基酸順序),錯義突變(非同義點突變,單個核苷酸改變導緻一個密碼子編碼一個不同的氨基酸)和無義突變(非同義點突變使一個密碼子變為(wèi)終止密碼子引起多(duō)肽鏈合成提前終止),共同構成了體(tǐ)細胞非同義突變的基本要素。
2. TMB相關因素:腫瘤突變負荷(tumormutation burden,TMB)、微衛星高度不穩定(microsatellite instability-high, MSI-H)和錯配基因修複缺失(mismatch-repairdeficiency,MMR),這些潛在的bio-marker又(yòu)指向一個共同點突變相關新(xīn)抗原(mutation-associated neoantigen)。
3. 腫瘤微環境種的PD-L1表達豐度及TIL數量。具(jù)體(tǐ)見荷蘭Christian U Blank在科(kē)學(xué)雜志(zhì)撰文(wén)并畫出的影響抗癌免疫反應的7大因素雷達圖。
4. 微生态:《科(kē)學(xué)》雜志(zhì)發表的五篇腸道微生物(wù)影響腫瘤免疫治療的研究文(wén)章,來闡述免疫療法療效與腸道微生物(wù)的關系。
2015年11月27日,《科(kē)學(xué)》雜志(zhì)發表了兩篇研究,首次指出癌症患者腸道微生物(wù)的組成,決定了以檢查點抑制劑(CTLA-4、PD-L1)為(wèi)代表的癌症免疫療法的有(yǒu)效性。由法國(guó)GustaveRoussy 癌症中(zhōng)心的免疫學(xué)家Laurence Zivogel博士領導的研究小(xiǎo)組發現,腸道中(zhōng)具(jù)有(yǒu)多(duō)形拟杆菌和脆弱類杆菌的小(xiǎo)鼠,在接受CTLA-4抗體(tǐ)治療時,會表現出更好的治療效果;而無菌小(xiǎo)鼠的腫瘤則對該治療幾乎沒有(yǒu)響應;在給無菌小(xiǎo)鼠移植特定菌株後,可(kě)以增強CTLA-4抗體(tǐ)療法的有(yǒu)效性。來自芝加哥(gē)大學(xué)的Thomas Gajewski團隊,也通過類似的方法,證明了雙歧杆菌屬有(yǒu)利于PD-L1抑制劑的抗腫瘤效果。
2017年11月2日,《科(kē)學(xué)》雜志(zhì)再次同時在線(xiàn)發表了兩篇重磅論文(wén)。
一篇《Gut microbiomeinfluences efficacy of PD-1–based immunotherapy against epithelial tumors》還是由兩年前的Laurence Zivogel博士團隊研究撰寫,這次的研究對象從老鼠轉移到了人類。該團隊對接受過PD-1抑制劑治療的249例癌症患者進行了分(fēn)析,其中(zhōng)69例患者因常規原因(如牙科(kē)治療或尿路感染),在接受PD-1治療前後服用(yòng)了抗生素。那些服用(yòng)抗生素的癌症患者,因為(wèi)抗生素導緻腸道菌群紊亂,在接受PD-1抑制劑治療之後,癌症很(hěn)快就複發,總體(tǐ)生存期(OS)竟然比未服用(yòng)抗生素的患者縮短了近45%!
研究人員還将人類患者的腸道微生物(wù)移植到無菌小(xiǎo)鼠身上,結果發現移植那些治療有(yǒu)效患者腸道微生物(wù)的小(xiǎo)鼠,接受PD-1/L1抑制劑治療同樣會有(yǒu)效,而移植無效患者的腸道微生物(wù),治療也就無效。具(jù)體(tǐ)試驗過程如下:
①分(fēn)析249名(míng)患肺癌、腎癌等腫瘤并接受抗PD-1免疫抑制劑治療的患者,69名(míng)同時接受廣譜抗生素(ATB);
②ATB患者平均總生存期為(wèi)8.3個月,遠(yuǎn)遠(yuǎn)低于非ATB患者的15.3個月;
③患者體(tǐ)内Akkermansia muciniphila(Akk菌)的相對豐度與對免疫檢查點抑制劑(ICI)的響應顯著相關;
④将對ICI響應的患者的糞菌移植給無菌小(xiǎo)鼠,可(kě)以改善PD-1抑制劑對小(xiǎo)鼠腫瘤的效果;
⑤移植對ICI不響應的患者糞菌的無菌小(xiǎo)鼠,在口服Akk菌後,也能(néng)恢複對PD-1抑制劑的響應。
同時刊發的另一篇論文(wén)中(zhōng),來自美國(guó)德(dé)克薩斯州大學(xué)安(ān)德(dé)森癌症中(zhōng)心的研究人員,對112名(míng)接受PD-1抑制劑治療的癌症患者進行了口腔和腸道微生物(wù)的分(fēn)析。結果發現免疫療法有(yǒu)效與無效患者的腸道菌群存在顯著差異,證實腸道微生物(wù)在免疫療法中(zhōng)扮演了極其關鍵角色。
2018年1月5日,ThomasGajewski團隊登頂《科(kē)學(xué)》封面,腸道微生物(wù)影響人類癌症患者免疫治療效果再次得到證實!研究人員通過對42名(míng)轉移性黑色素瘤患者的糞菌構成進行分(fēn)析,結果證明患者腸道菌群與PD-1免疫療法的效果之間存在顯著關聯,并在對治療響應明顯的患者腸道菌群中(zhōng),鑒定出高豐度的長(cháng)雙歧杆菌、産(chǎn)氣柯林斯菌和屎腸球菌,并發現在給無菌小(xiǎo)鼠移植這些人類患者的腸道微生物(wù)後,能(néng)夠顯著增強小(xiǎo)鼠的腫瘤免疫應答(dá)和腫瘤控制。
有(yǒu)人會問,為(wèi)什麽不同的研究團隊鑒定出的菌群種類不完全一緻,North Carolina大學(xué)Scott Bultman教授表示:“研究對象所處地理(lǐ)位置和飲食習慣不同,腸道菌群不同是正常的,而且不同研究之間也存在一定的重合度。”
另外一些因素:
療效好的:吸煙、近期放療
療效差的:EGFR基因突變。
KRAS突變,似乎不影響療效:總體(tǐ)人群的臨床獲益率為(wèi)29%,攜帶KRAS突變的患者臨床獲益率是36%,兩者無統計學(xué)差異。關于這一點,要做一下額外的補充:事實上,KRAS突變的非小(xiǎo)細胞肺癌可(kě)以分(fēn)為(wèi)三類。
(1)同時攜帶KRAS和P53突變的患者,這類患者對PD-1治療敏感;
(2)同時攜帶KRAS和STK11突變的患者,這類患者對PD-1治療抵抗;
(3)其他(tā)患者,對PD-1治療的有(yǒu)效率居中(zhōng)。
在本次研究中(zhōng),①攜帶STK11突變的患者,接受PD-1抑制劑治療,的确是有(yǒu)效率更差的;②JAK突變、B2M突變的患者,要當心,③PD-L1表達和TMB高低無關④MDM2、MDM4擴增的患者,是否會發生超進展,有(yǒu)待進一步研究。
五、毒性管理(lǐ)與療效評價
細胞因子釋放綜合症(Cytokine Release Syndrome, CRS):
在CAR-T細胞治療過程中(zhōng)發生的一種過度免疫反應。臨床表現主要包括:發熱;特征性細胞因子升高;和臨床毒性的存在(表1)。并發CRS患者的典型發燒,通常在回輸CAR-T細胞後約24小(xiǎo)時開始并且可(kě)以持續數天。然而,發燒并不總能(néng)夠預示臨床發生相關毒性的多(duō)少,嚴重程度和發病趨勢。
至少7個細胞因子水平在血清中(zhōng)的增高與患者發生CRS具(jù)有(yǒu)明确的相關性,這些細胞因子是:IFN-γ (幹擾素-γ),Fracktalkine (分(fēn)形趨化因子),GM-CSF (粒-巨噬細胞生長(cháng)因子),IL-5(白細胞介素-5),IL-6(白細胞介素-6),Flt-3L (人FMS樣酪氨酸激酶3配體(tǐ))和IL-10 (白細胞介素-10)。
7種細胞因子在需要治療的重症CRS患者中(zhōng),至少有(yǒu)2項比治療前基線(xiàn)水平增高75倍。重症CRS患者都出現了至少一個下述臨床表現:缺氧,低血壓,和/或神經系統的異常改變。
因此,結合臨床和實驗室數據,可(kě)以根據以下3項指标來确診患者CRS的發生:
1. 持續發燒超過3天(~38C°);
2. 選擇性細胞因子升高;
3.伴有(yǒu)臨床毒性反應的證據。
上述标準可(kě)以将患者分(fēn)為(wèi)重症CRS組和非CRS組。非CRS組患者包括未發生CRS患者,也包括僅有(yǒu)低熱和輕度細胞因子增高的輕度CRS患者。重症CRS患者需要密切觀察和治療幹預。非CRS患者僅需要常規觀察和一般性對症處理(lǐ)。重症CRS患者平均住院時間為(wèi)56.7天(SD=28.6;範圍20-104天)。非CRS患者平均住院15.1天(SD=18.8;範圍:4-61天)。
盡管在CAR-T治療引起的嚴重副作(zuò)用(yòng)發生之前,檢測血清CRS相關細胞因子,可(kě)以指導臨床診斷和治療,但是每天快速實時檢測細胞因子,因技(jì )術上的限制并不現實可(kě)行。研究發現,血清急性反應蛋白之一,C-反應蛋白(CRP)水平的增減與CRS時患者血清IL-6水平和IL-6受體(tǐ)阻滞劑治療後顯著相關。同樣C-反應蛋白水平與類固醇藥物(wù)對CRS的療效顯示了明顯的負相關。因此認為(wèi)C-反應蛋白是預測CRS的一個良好指标。C-反應蛋白水平超過正常阈值預示具(jù)有(yǒu)CRS發生的高度危險性,C-反應蛋白測定的敏感性約86%,而特異性為(wèi)100%。

細胞因子釋放綜合症的處理(lǐ)
重症CRS産(chǎn)生的不良反應和毒性作(zuò)用(yòng)需要有(yǒu)效和強力的醫(yī)療幹預。通常包括血管活性升壓藥支持,呼吸機支持,使用(yòng)抗癫痫藥和解熱鎮痛藥物(wù)。盡管這些毒副作(zuò)用(yòng)令人擔心,迄今為(wèi)止,在正确有(yǒu)效的醫(yī)療處理(lǐ)條件下,臨床上CRS已經是完全可(kě)逆性的。
采用(yòng)大劑量類固醇激素相當于每天100mg以上強的松劑量,可(kě)以迅速逆轉CRS的臨床症狀。然而,問題的另一方面是,類固醇藥物(wù)也能(néng)抑制CAR-T的體(tǐ)内增殖,使得使用(yòng)類固醇類藥物(wù)治療CRS的患者,有(yǒu)較高的複發率,影響CAR-T治療的療效。
白細胞介素-6受體(tǐ)(IL-6R)阻斷性單克隆抗體(tǐ)藥物(wù)(Tocilizumab)也可(kě)以用(yòng)來治療和改善CRS的毒副作(zuò)用(yòng)。已有(yǒu)臨床試驗證明,阻斷IL-6受體(tǐ)後能(néng)迅速解決CRS帶來的毒副作(zuò)用(yòng)。在3例CRS患者中(zhōng)(患者血清中(zhōng)IL-6濃度增高達正常濃度的27-400倍),單獨使用(yòng)Tocilizumab抗體(tǐ)後,患者發燒和CRS症狀在1-3日内明顯緩解,療效與類固醇療法相似,外周血檢測顯示Tocilizumab治療對CAR-T細胞體(tǐ)内增殖沒有(yǒu)影響。
CAR-T治療能(néng)引起對神經系統的毒性作(zuò)用(yòng)。患者可(kě)能(néng)出現可(kě)逆性神經系統并發症。包括神志(zhì)不清和癫痫樣症狀。患者可(kě)以發生漸進性的神志(zhì)混亂,詞語困難,失語,可(kě)最終發展到反應遲鈍。有(yǒu)些患者的神經系統并發症發展到需要氣管插管及機械輔助通氣等措施,以便對呼吸道加以保護。對神經系統并發症的檢查,CT和磁共振成像常無特别發現。腦電(diàn)圖能(néng)确診癫痫樣腦電(diàn)波活動,有(yǒu)助于指導抗癫痫治療的處理(lǐ)。
ICIs治療相關毒性管理(lǐ):
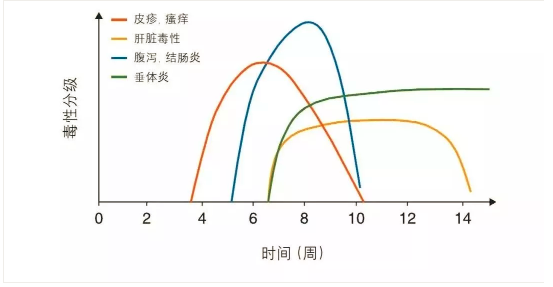
針對細胞毒T淋巴細胞相關抗原4(cytotoxicT lymphocyte-associated antigen 4, CTLA4)和程序性死亡受體(tǐ)(programmed death-1 receptor,PD-1)及其配體(tǐ)PD-L1的單克隆抗體(tǐ)(monoclonalantibodies,MoAbs)治療已經成為(wèi)越來越多(duō)腫瘤的标準治療。越來越多(duō)的患者應用(yòng)這些藥物(wù)的同時也可(kě)能(néng)會出現治療相關的毒性。毒性發生率在不同的免疫檢查點抑制藥物(wù)之間也不盡相同。
免疫檢查點抑制劑(immunecheckpoint inhibitors,ICPi)的毒性可(kě)以分(fēn)為(wèi)輸注反應和免疫相關不良事件(immune-related adverse events,irAE)或特殊關注的不良事件(adverseevents of special interest,AEoSI)。ESMO臨床實踐指南僅涉及後者。雖然某些髒器的irAE更加常見,但實際任何器官和組織都有(yǒu)可(kě)能(néng)受累。最常發生的irAE主要累及皮膚、結腸、内分(fēn)泌器官、肝髒和肺;其他(tā)組織和器官雖然少見,但有(yǒu)可(kě)能(néng)相對更嚴重、甚至是緻命的,比如神經系統病變和心肌炎。
Ipilimumab的免疫相關毒性
Ipilimumab,一種抗CTLA4單抗,臨床劑量為(wèi)3mg/kg時,60%~85%的人群出現irAE:大多(duō)數是1~2級毒性,約10%~27%的人會發生3~4級毒性,在早期的3期臨床研究中(zhōng)有(yǒu)2.1%的患者出現ipilimumab相關的死亡。這些毒性發生的時間各不相同,但大多(duō)出現在治療開始後的8~12周[圖中(zhōng)列出了ipilimumab治療後不良事件(adverseevents,AE)的發生時間],皮膚毒性常為(wèi)首發症狀。這些毒性特征表現為(wèi)劑量依賴性:ipilimumab劑量為(wèi)0.3 mg/kg時并沒有(yǒu)觀察到3~4級的不良事件,而使用(yòng)10mg/kg時,3~4級毒性上升到30%。當ipilimumab 10 mg/kg繼以維持劑量作(zuò)為(wèi)輔助治療時,3~4級irAE的發生率為(wèi)41.6%,5級irAE的發生率為(wèi)1.1%。對于1-2級的皮膚AE,繼續應用(yòng)(至少1周)ICPi。如果出現瘙癢,則開始應用(yòng)外用(yòng)潤膚劑、抗組胺藥和/或糖皮質(zhì)激素(低強度)乳膏。當AE≤1級時重新(xīn)開始應用(yòng)ICPi。對于3級的皮膚AE,暫停ICPi,并立即應用(yòng)外用(yòng)潤膚劑、抗組胺藥和高強度的糖皮質(zhì)激素乳膏[II, B]。對于4級的皮膚AE,停用(yòng)ICPi(永久),考慮收患者入院,并立即與皮膚科(kē)醫(yī)生會診。開始應用(yòng)經靜脈給藥的糖皮質(zhì)激素[1–2 mg/kg(甲基)強的松],并根據AE的緩解情況逐漸減量[II, B]。
療效評價
目前的試驗結果發現腫瘤微環境中(zhōng)PD-L1和淋巴細胞雙陽性的病人在黑色素瘤中(zhōng)有(yǒu)45%,肺癌中(zhōng)有(yǒu)17%, 膀胱癌中(zhōng)有(yǒu)32%,這個比例和臨床試驗抗PD-1/PD-L1治療的反應率很(hěn)相似。
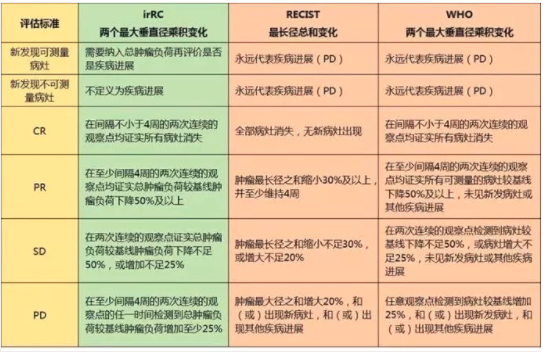
2009年國(guó)際上建議并制定腫瘤免疫治療的療效判斷新(xīn)标準—免疫相關反應标準(Immune-RelatedResponse Criteria,irRC),以彌補RECIST或改良後的WHO标準并不完全适用(yòng)于抗腫瘤細胞免疫治療的缺陷。
六、ICIs耐藥現象的解釋
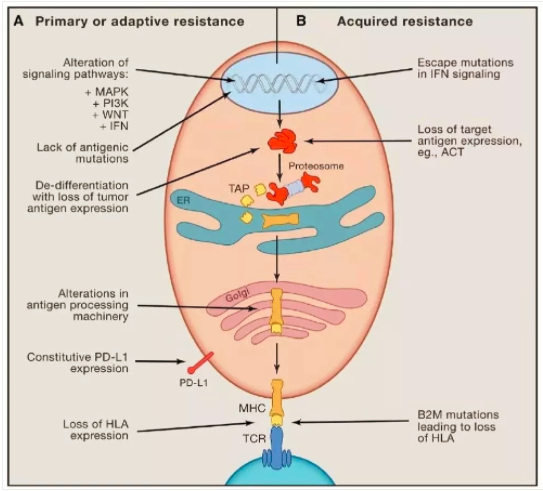
為(wèi)何有(yǒu)些腫瘤抵抗PD-1/PD-L1治療,陳列平教授将耐藥性腫瘤分(fēn)為(wèi)3類:
① Target-missingresistance:這些腫瘤不表達PD-L1,或者有(yǒu)PD-L1但沒有(yǒu)T淋巴細胞(缺乏PD-1),因此屬于靶子缺失型。這種腫瘤對PD-1/PD-L1抗體(tǐ)治療不可(kě)能(néng)有(yǒu)效果。明顯有(yǒu)其他(tā)逃逸機制在起作(zuò)用(yòng)。
② Primaryresistance:腫瘤微環境中(zhōng)有(yǒu)PD-L1,也有(yǒu)T細胞,但病人對PD-1/PD-L1抗體(tǐ)治療沒有(yǒu)反應。這樣的情況比較少見。
③ Acquiredresistance:腫瘤微環境中(zhōng)有(yǒu)PD-L1,也有(yǒu)T細胞。病人對PD-1/PD-L1抗體(tǐ)治療最初也有(yǒu)反應,但是後來腫瘤複發,用(yòng)PD-1/PD-L1抗體(tǐ)再治療也無效。這一種才是真正的耐藥。
MD安(ān)德(dé)森的Padmanee Sharma發表文(wén)章《Primary, Adaptive, andAcquired Resistance to Cancer Immunotherapy》讨論ICIs的耐藥機制。
腫瘤免疫療法的一個顯著特點是腫瘤響應的時間長(cháng),但是在使用(yòng)anti-CTLA-4或anti-PD-1治療黑色素瘤的患者中(zhōng),大約有(yǒu)1/4-1/3的患者在經曆初始響應後出現了腫瘤進展,即獲得性耐藥。獲得性耐藥的産(chǎn)生的主要是腫瘤細胞上特定基因或通路的表達或上調,從而導緻腫瘤微環境中(zhōng)免疫細胞的浸潤以及功能(néng)受到抑制。例如,T細胞功能(néng)的喪失,腫瘤抗原提呈出現缺陷以及其他(tā)一些新(xīn)突變的産(chǎn)生。例如,在一類較晚獲得anti-PD-1耐藥性的病人中(zhōng),發現了B2M的突變,從而導緻抗原提呈機制缺陷。在另兩例獲得性耐藥腫瘤中(zhōng),發現了IFNγ通路中(zhōng)JAK1或JAK2發生了突變。PD-1抗體(tǐ)隻是解除了“T細胞枷鎖”,疾病的控制最終還是要通過T細胞實現,因此,凡是影響T細胞招募、激活等功能(néng)的,均能(néng)夠最終影響PD-1抗體(tǐ)的臨床收益。
導緻免疫療法耐藥的腫瘤内在原因:
①MAPK通路的激活與或PTEN表達的缺失而引起的PI3K通路的增強:
癌基因信号通過MAPK通路導緻VEGF與IL-8的産(chǎn)生,從而抑制T細胞的招募與功能(néng)。腫瘤抑制基因PTEN表達缺失從而PI3K通路增強,這與IFNγ,顆粒酶B的基因表達量降低以及腫瘤浸潤CD8+T細胞的數目減少是高度相關的。
②WNT/β-catenin信号通路的持續表達:
癌基因信号通過穩定β-catenin導緻WNT信号通路持續激活,從而将T細胞排除在腫瘤之外。在人Non-T-cell-inflamed的黑色素瘤中(zhōng),腫瘤内在的β-catenin信号基因高度表達,且在腫瘤微環境中(zhōng)缺少T細胞與CD103+DC細胞。
③腫瘤上PD-L1的高表達:
腫瘤上高表達的某些配體(tǐ)如PD-L1,會抑制抗腫瘤T細胞的應答(dá)。多(duō)種機制可(kě)能(néng)導緻PD-L1高表達,包括PTEN的缺失或PI3K/AKT的突變,EGFR突變,MYC過表達,CDK5基因破壞以及PD-L1基因3’-UTR的截短。目前還不知道PD-L1的高表達是否會對anti-PD-1/PD-L1的響應有(yǒu)影響,但是它會影響其他(tā)的腫瘤免疫療法。
IFNγ信号通路的缺失:由腫瘤特異的T細胞産(chǎn)生的IFNγ,能(néng)夠識别腫瘤細胞或抗原遞呈細胞上的相應受體(tǐ),從而發揮有(yǒu)效的抗腫瘤免疫響應。IFNγ能(néng)夠增強MHC分(fēn)子的表達,從而增強腫瘤抗原提呈作(zuò)用(yòng)。IFNγ也能(néng)夠招募其他(tā)的免疫細胞,或者直接抑制腫瘤細胞的增殖,促進其凋亡。因此腫瘤細胞上IFNγ通路相關蛋白,如IFNγ受體(tǐ)IFNGR1與IFNGR2,IFNγ受體(tǐ)鏈JAK1與JAK2,STATs,IRF1等突變與缺失,都會導緻對免疫檢查點抑制劑的耐藥。
④缺少腫瘤抗原:
免疫療法依賴于腫瘤抗原特異的T細胞。在人黑色素瘤,腎細胞癌,非小(xiǎo)細胞肺癌中(zhōng),DNA突變頻率高,腫瘤免疫原性更強,因而對anti-PD-1療法響應更好。而在胰腺癌以及前列腺癌中(zhōng),DNA突變頻率低,腫瘤免疫原性低,對anti-PD-1療法響應差。
⑤抗原提呈機制存在缺陷:
在某些情況下,由于抗原加工(gōng)過程中(zhōng)的蛋白酶體(tǐ)成員,轉運蛋白,MHC本身以及beta-2-微球蛋白(B2M)的功能(néng)缺陷,會導緻抗原提呈機制不能(néng)有(yǒu)效地将腫瘤抗原提呈到細胞表面。B2M在HLAI家族的折疊與轉運到細胞膜的過程中(zhōng)發揮關鍵作(zuò)用(yòng),若其喪失功能(néng),則CD8+T細胞失去了識别功能(néng)。
⑥存在一系列特定基因的表達:
在對PD-1療法沒有(yǒu)響應的腫瘤中(zhōng),有(yǒu)一些基因表達被富集,被稱為(wèi)innate anti-PD-1 resistance signature,或IPRES。這些基因與間葉細胞的轉化,全能(néng)型以及傷口愈合相關,且更傾向于表達在胰腺癌等對PD-1不響應的腫瘤中(zhōng)。
導緻原發性/繼發性耐藥的腫瘤外部原因:
這些原因是由于腫瘤微環境中(zhōng)一些成員發揮抗癌免疫響應的抑制作(zuò)用(yòng),主要包括調節T細胞Tregs,髓樣抑制細胞MDSCs,M2巨噬細胞,其他(tā)的抑制性免疫檢查點與抑制性細胞因子等。
① Tregs:
Tregs能(néng)通過分(fēn)泌抑制性細胞因子或者通過直接的細胞接觸來抑制效應T細胞Teffs的響應。許多(duō)人腫瘤中(zhōng)發現了浸潤的Tregs,且鼠模型中(zhōng)去除腫瘤微環境中(zhōng)的Tregs能(néng)夠顯著提高免疫響應。由于CTLA-4在Tregs上高表達,anti-CTLA-4能(néng)夠顯著提高Teffs/Tregs的比例,從而提高腫瘤對免疫療法的響應。
② Myeloid-derivedsuppressor cells (MDSCs):
MDSCs在多(duō)種病理(lǐ)條件包括腫瘤,發揮着免疫響應調節因子的作(zuò)用(yòng)。人MDSCs表達CD11b+與CD33+,但是不表達HLA-DR以及系種特異的抗原CD3,CD19與CD57。MDSCs能(néng)夠促進血管生長(cháng),腫瘤侵襲與轉移。腫瘤微環境中(zhōng)MDSCs的存在與降低的生存率以及免疫檢查點抑制劑療法的響應率相關。目前實驗中(zhōng)使用(yòng)PI3Kγ抑制劑來調節巨噬細胞功能(néng),在老鼠模型中(zhōng),PI3Kγ抑制劑與anti-PD-1聯用(yòng)表現出了良好的腫瘤抑制效果。
③ M2macrophages:
腫瘤相關的巨噬細胞(Tumor-Associated Macrophages,TAMs)也能(néng)夠影響免疫治療的響應。TAMs包括M1巨噬細胞和M2巨噬細胞,在大多(duō)數情況下M2巨噬細胞占TAMs的大多(duō)數。其中(zhōng)M1巨噬細胞能(néng)夠高表達IL-12,IL-23,MHC以及B7家族分(fēn)子來促進抗原提呈與Th1細胞的激活,從而發揮抗腫瘤免疫作(zuò)用(yòng);而M2巨噬細胞能(néng)夠分(fēn)泌抑制性細胞因子IL-10與TGF-β,從而抑制免疫響應與促進腫瘤生長(cháng)與轉移。臨床上TAMs的數目越多(duō),腫瘤預後就越差。臨床前實驗使用(yòng)巨噬細胞集落刺激生長(cháng)因子受體(tǐ)1(CSF-1R)的抑制劑,能(néng)夠顯著減少TAMs數目,抑制腫瘤生長(cháng)。CSF-1R抑制劑與anti-CTLA4或anti-PD1再加上吉西他(tā)濱聯用(yòng),能(néng)夠有(yǒu)效緩解單獨anti-CTLA-4或anti-PD1不響應的鼠胰腺癌模型。
④ 其他(tā)的抑制性免疫檢查點:
除了PD-1與CLTA-4,T細胞上還存在其他(tā)的抑制性免疫檢查點,包括TIM-3,LAG-3,BTLA,TIGIT,和VISTA等。2016年《naturecommunication》上,有(yǒu)研究者發現anti-PD-1耐藥性的産(chǎn)生與抑制性免疫檢查點TIM-3的的表達量升高密切相關。在兩個老鼠腫瘤模型中(zhōng),耐藥後與給藥前相比,腫瘤浸潤的T細胞而非外周血或脾髒T細胞上的TIM-3表達量顯著上調,且TIM-3表達量上調的主要是那些結合了anti-PD-1抗體(tǐ)的T細胞。
需注意的是TIM-3表達量升高是anti-PD-1療法特異的,因為(wèi)anti-CTLA-4中(zhōng)并未檢測到類似現象。此外,腫瘤細胞上TIM-3配體(tǐ)Galectin-9的表達量也顯著升高。當anti-PD-1療法出現耐藥後,聯用(yòng)anti-TIM-3,顯著提高了生存率。有(yǒu)意思的是,當anti-PD-1和anti-TIM-3聯用(yòng)被耐藥,腫瘤重新(xīn)進展時,那些結合了anti-PD-1和anti-TIM-3抗體(tǐ)的T細胞上,其他(tā)的抑制性免疫檢查點如CTLA-4,LAG-3的表達量明顯升高。
這說明了腫瘤浸潤T細胞的抑制性免疫調節是動态變化的,存在着補償效應。最後,在兩例對anti-PD-1療法獲得性耐藥的NSCLC病人腫瘤樣本中(zhōng),也觀察到了TIM-3而非其他(tā)抑制性免疫檢查點的表達量顯著升高。這些結果說明了anti-PD-1和anti-TIM-3聯用(yòng)是對于那些anti-PD-1療法獲得性耐藥病人的一個良好策略。
免疫抑制細胞因子與免疫抑制分(fēn)子:
腫瘤或者巨噬細胞會釋放一些免疫抑制細胞因子或者免疫抑制分(fēn)子來減弱局部的抗腫瘤免疫反應。腫瘤微環境中(zhōng)的免疫因子或免疫細胞的異常表達
某些免疫因子如激活型免疫因子(IL-12,IL-23),抑制性免疫因子(IL-10與TGF-β),免疫細胞如Tregs, Myeloid-derivedsuppressor cells 等能(néng)夠顯著影響抗體(tǐ)的臨床治療效果。TGF-β能(néng)夠促進血管生成,刺激Tregs從而發揮免疫抑制作(zuò)用(yòng)。
在多(duō)種腫瘤中(zhōng),高水平的TGF-β都伴随着極差的預後。臨床前實驗使用(yòng)TGF-β受體(tǐ)激酶抑制劑與anti-CTLA-4聯用(yòng),或者放療與TGF-β抑制劑都顯示出了較好的腫瘤抑制效果。在細胞外,CD39能(néng)夠将ATP水解成AMP,進一步被胞外核苷酶CD73加工(gōng)為(wèi)免疫抑制分(fēn)子腺苷adenosine。Adenosine能(néng)夠通過T細胞上的A2A受體(tǐ)抑制T細胞的增殖與細胞毒活性,也能(néng)通過腫瘤細胞上的A2B受體(tǐ)促進腫瘤轉移。
多(duō)種類型的腫瘤中(zhōng),CD73的高表達伴随着較差的預後,且會影響anti-PD-1的效果。此外,IFNγ會促進免疫抑制分(fēn)子IDO的表達,IDO能(néng)直接負調控效應T細胞的功能(néng)。
趨化因子與趨化因子受體(tǐ):
某些特異的趨化因子與趨化因子受體(tǐ)在MDSCs和Tregs往腫瘤微環境的運輸過程中(zhōng)起到重要作(zuò)用(yòng)。腫瘤細胞能(néng)夠分(fēn)泌配體(tǐ)CCL5,CCL7和CXCL8,通過結合MDSCs上表達的CCR1及CXCR2受體(tǐ),從而将MDSCs吸引至腫瘤微環境中(zhōng)。
CCR4在Tregs上高表達,anti-CCR4能(néng)夠有(yǒu)效抑制T細胞的招募并通過ADCC效應減少Tregs的數目。此外CXCR4是CXCL12的受體(tǐ),CXCL12能(néng)夠通過影響Tregs定位等多(duō)種方式發揮免疫抑制作(zuò)用(yòng)。
腫瘤浸潤細胞上CD28的表達:
CD28是T細胞的共刺激分(fēn)子,對于T細胞的激活,增殖和存活起到關鍵作(zuò)用(yòng)。在人出生時,所有(yǒu)T細胞都會表達CD28,但是CD28的表達量會随着年齡的增加而下降,80歲時會有(yǒu)10-15%的CD4+T細胞以及50-60%的CD8+ T細胞缺失CD28表達。CD28-T細胞産(chǎn)生的主要原因是重複的抗原刺激。CD28表達的消失隻存在與人和靈長(cháng)動物(wù)中(zhōng),在鼠中(zhōng)并沒有(yǒu)被發現。
2017年03月09号,science期刊發表了來自Emory疫苗中(zhōng)心的研究工(gōng)作(zuò),他(tā)們發現CD28對于耗盡的CD8+T細胞(ExhaustedCD8+ T Cell)的再激活是必須的。在老鼠模型中(zhōng),阻斷CD28-B7共刺激通路,會影響腫瘤特異CD8+T細胞的增殖和激活,降低對anti-PD-1/PD-L1療法的響應。
在經過anti-PD-1治療的NSCLC病人中(zhōng),增殖的CD8+T細胞(高Ki-67表達)大都為(wèi)PD-1陽性,且被激活(高HLA-DR,CD38表達)。和鼠模型中(zhōng)一樣,這些增殖的CD8+T細胞大都是CD28陽性的,說明了CD28共刺激對于腫瘤浸潤的PD-1+CD8+T細胞的增殖與再激活是至關重要的。因此,CD28可(kě)以用(yòng)作(zuò)預測anti-PD-1療法響應程度的分(fēn)子标記。
抗體(tǐ)藥物(wù)失效的可(kě)能(néng)原因是巨噬細胞“吃掉”了它:
MGH研究人員将PD-1抗體(tǐ)opdivo、腫瘤細胞、T細胞、巨噬細胞等分(fēn)别染色,發現PD-1抗體(tǐ)能(néng)夠與巨噬細胞表面的Fcγ受體(tǐ)結合,從而被巨噬細胞“吃掉”,這在體(tǐ)外細胞實驗和小(xiǎo)鼠體(tǐ)内均得到證實,同時研究人員發現酶PNGaseF能(néng)過抑制該吞噬過程,這給PD-1抗體(tǐ)臨床治療方案的優化提供思路。

ICIs抗體(tǐ)藥物(wù)耐藥對策:
①聯合用(yòng)藥:多(duō)個免疫檢查點抑制劑藥物(wù)的聯合使用(yòng)(opdivo聯合yerovy)。
②抗體(tǐ)藥物(wù)和化療藥物(wù)的聯合使用(yòng):如keytruda+培美曲塞+卡鉑聯合治療方案。
③在生物(wù)标志(zhì)物(wù)的指導下采取個性化治療方案,以獲得更高的臨床收益。
七、臨床應用(yòng)

人類對癌症的認知經曆了細胞與分(fēn)子生物(wù)學(xué)水平的演進,目前對癌的解釋可(kě)以概括為(wèi):自身體(tǐ)細胞在基因組突變積累的基礎上出現失控增殖表型和遷移失控表型并可(kě)能(néng)表達異常信号分(fēn)子,通過占位效應和分(fēn)子毒性效應導緻原宿主多(duō)細胞系統代謝(xiè)奔潰的生命現象。
這種現象見于各種動物(wù),但不同物(wù)種發病率不同,在人類60歲以後癌症是常見緻死緻殘性疾病,如果一個人活到80歲有(yǒu)50%可(kě)能(néng)性出現癌症類現象,癌症的異質(zhì)性很(hěn)大,有(yǒu)些即使很(hěn)大也未必緻死,有(yǒu)些即使轉移也能(néng)較長(cháng)時間存活。
人類在癌症免疫療法取得突破性進展之前主要的局部治療有(yǒu):外科(kē)式手術刀(dāo)或者物(wù)理(lǐ)化學(xué)消融性微創外科(kē)、放射線(xiàn)治療、化學(xué)藥物(wù)、分(fēn)子靶向藥物(wù)(各種抗體(tǐ)或者小(xiǎo)分(fēn)子酪氨酸激酶抑制劑)。
當前比較成功的抗癌免疫治療方法是CART-T過繼免疫治療和免疫檢測點抑制劑。前者在血液腫瘤取得了很(hěn)大的成功,後者在血液腫瘤及實體(tǐ)腫瘤均顯示了療效。傳統的抗癌療法與免疫治療具(jù)有(yǒu)協同效應,而且傳統的抗癌療法也對免疫系統或免疫反應有(yǒu)一定影響:
① 化療藥物(wù)吉西他(tā)濱、卡培他(tā)濱及環磷酰胺在破壞癌細胞的同時釋放的癌細胞壞死物(wù)比其它化療或分(fēn)子靶向内分(fēn)泌藥物(wù)更具(jù)有(yǒu)抗原性。
② 物(wù)理(lǐ)如放射線(xiàn)或者物(wù)理(lǐ)化學(xué)消融如熱冷及酒精(jīng)等消融技(jì )術殺死的癌細胞裂解物(wù)也具(jù)有(yǒu)一定免疫原性,甚至可(kě)導緻殘餘腫瘤消退。
③ 外科(kē)大手術創傷大具(jù)有(yǒu)免疫抑制效應,切除過程中(zhōng)的癌細胞破碎可(kě)導緻癌細胞脫落轉移,當然也可(kě)能(néng)會導緻免疫原性反應。
未來的方向是:
①了解原發和繼發耐藥的機制。
原發耐藥:微環境中(zhōng)缺乏靶點,或者存在另外的免疫抑制機制。
繼發耐藥:TME發展出一些針對ICIs的新(xīn)機制,如直接吞噬抗體(tǐ)。
②了解TME免疫抑制的整體(tǐ)框架。
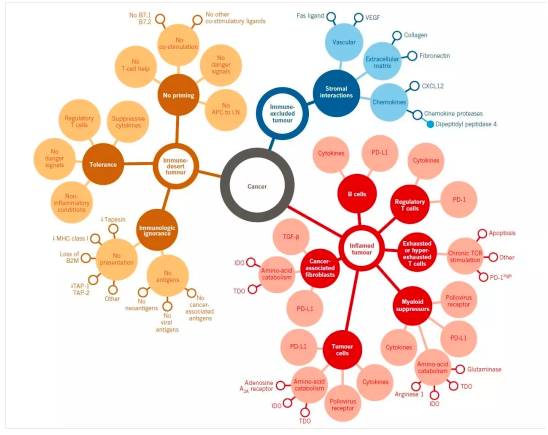
現在看來,在癌症病竈中(zhōng)肯定存在着一種類似保護罩似的局部結構,我覺得可(kě)以從以下幾方面理(lǐ)解:
-
全身性的:癌症細胞群可(kě)以釋放全身性的代謝(xiè)和免疫抑制劑,以調節全身全身的代謝(xiè)與營養、免疫狀态。
-
局部可(kě)溶性分(fēn)子(來自癌巢中(zhōng)的癌細胞和間質(zhì)細胞):在局部微環境形成高濃度的抑制溶劑。
-
局部不可(kě)溶解性的(來自癌巢中(zhōng)的癌細胞和間質(zhì)細胞):間質(zhì)裏的膠原蛋白纖維間隔等組織骨架。其實感覺組織骨架就是植物(wù)細胞的細胞壁似的物(wù)質(zhì),或者類似于植物(wù)的纖維素,構建組織微環境并支持多(duō)細胞系統的基本形态。
-
癌細胞表面的:典型的如PD-L1。
-
間質(zhì)細胞層次的:如MDSC、癌性相關纖維母細胞和癌性巨噬細胞。
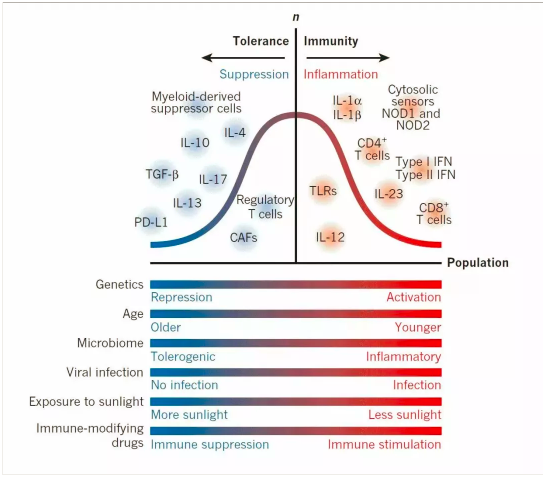
③闡明轉移癌細胞離開腫瘤微環境為(wèi)啥可(kě)以存活的機制。理(lǐ)解轉移前和轉移後微環境的免疫學(xué)性質(zhì)變化。
癌細胞離開創始根據地去宿主的其它地盤上開疆拓土是一件風險極大的事情。進入血液中(zhōng)的癌細胞存活下來的機率非常低,多(duō)數被殺死或者自己死亡。能(néng)夠粘附血管壁并進入周圍組織存活下來的又(yòu)低了許多(duō)。不過有(yǒu)證據表明,即使血液中(zhōng)可(kě)以檢測到存活癌細胞,但最終的解決有(yǒu)以下幾種:
-
全挂在血液中(zhōng)或在建設新(xīn)的根據地的過程中(zhōng)。
-
到了某根據地,但是不适合發展,長(cháng)期潛伏,甚至終身無用(yòng);也有(yǒu)可(kě)能(néng),在N年後的某一天,獲得合适機會再發展起來。臨床上可(kě)以觀察到很(hěn)多(duō)年後複發的乳腺癌之類。
-
到了根據地,迅速發展起來。
④闡明構建癌症免疫和代謝(xiè)之間的關系。
代謝(xiè)是生命的基本特征,所有(yǒu)有(yǒu)生命系統的根本特征。本質(zhì)上所有(yǒu)的生命都是由基本粒子組成的,基本粒子組成了原子,原子組成了分(fēn)子,這種不斷的系統化後使得系統有(yǒu)了超級複雜性和有(yǒu)序性。為(wèi)了維持超級系統,系統必須要代謝(xiè)物(wù)質(zhì)并攝入能(néng)量。
免疫是廣義的代謝(xiè)概念的一種,代謝(xiè)包含了免疫機能(néng)在内。多(duō)細胞化後的動物(wù)代謝(xiè)負荷加大,為(wèi)了供應所有(yǒu)的細胞盡可(kě)能(néng)獲得營養物(wù)質(zhì),多(duō)細胞體(tǐ)系特化了循環系統;為(wèi)了提高攝食效率,發展了運動系統;為(wèi)了協調運動系統和内在運動系統循環系統的效率,發展了神經系統。神經系統是一種高級精(jīng)準的協調系統,後來居上地位于内分(fēn)泌和免疫系統之上,免疫系統是消化系統的補充系統。内分(fēn)泌系統負責各功能(néng)細胞群的遠(yuǎn)距離近距離通訊,媒介為(wèi)化學(xué)分(fēn)子。
⑤闡明癌症免疫與細胞行為(wèi)調控的關系。
人體(tǐ)細胞在過去的35億年裏一直在變化,直至成為(wèi)今天的細胞形态與功能(néng)之前它經曆了複雜的演化過程。最近6億年的演化過程中(zhōng),人體(tǐ)細胞的祖先是一個開放的系統,接受一切有(yǒu)利于自己的整合。人類基因組中(zhōng)的基因規模目前尚不是很(hěn)清楚,推測由3萬條基因單位。這些基因是長(cháng)時間和地球外界自然環境相互作(zuò)用(yòng)的結果,經曆了殘酷的自然選擇過程和對外界的同化過程,才建立起了今天的規模。人類基因組呈現豐富的多(duō)态性,既與演化的分(fēn)支有(yǒu)關,如6萬年前就與歐洲人分(fēn)開的亞洲人與歐洲人之間存在顯著的表型差異;也與外界環境有(yǒu)關,如病毒基因組序列對人類基因組的轉染與整合,外界自然有(yǒu)利有(yǒu)害突變的積累,以及生活方式和生殖方式對現有(yǒu)基因組體(tǐ)系構建的影響。
免疫系統的基本架構早在單細胞階段就已構建了起來。例如免疫球蛋白的結構在人體(tǐ)内是一個巨大的家族,包括了細胞上的受體(tǐ)(TCR)、MHC等,根據FC段的不同又(yòu)分(fēn)類為(wèi)5種免疫球蛋白。到了多(duō)細胞階段後,免疫系統已經分(fēn)化為(wèi)一個龐雜巨大的網絡系統,雖然經常出錯:如不能(néng)完全遏制由于人類基因組不穩定性帶來的異常增殖性突變,本來細胞的增殖是統一于宏觀的神經内分(fēn)泌調控的。這種增殖可(kě)能(néng)會伴有(yǒu)移動性病竈擴散,即所謂的惡性增殖、毒性增殖。
題外話:物(wù)理(lǐ)學(xué)視角下人生演化過程
基本粒子的費米特性,泡利不相容原理(lǐ),使得原子組成的世界按照層次的原則組建了起來,出現了多(duō)層次的生物(wù)進化。每個生物(wù)個體(tǐ)都是一個宇宙在重演的宇宙的曆史,個體(tǐ)人也不例外。多(duō)細胞動物(wù)人雖然看起來很(hěn)複雜,其實基本的構成不外代謝(xiè)與免疫2個,還有(yǒu)一個是與其共生的微生态。
代謝(xiè)是外在的免疫,免疫是内在的代謝(xiè);代謝(xiè)的本質(zhì)是同化,免疫的本質(zhì)是清除。
版權聲明
本公(gōng)衆号所有(yǒu)轉載文(wén)章是出于傳遞信息,分(fēn)享熱點的目的,同時明确注明來源和作(zuò)者,不希望被轉載的媒體(tǐ)或個人可(kě)與我們聯系(marketing@Countstar.cn),我們将立即進行删除處理(lǐ)。所有(yǒu)文(wén)章僅代表作(zuò)者觀點,不代表本站立場。


