CAR-T細胞治療監管概述
近年來,細胞治療産(chǎn)品,尤其是嵌合抗原受體(tǐ)T細胞(CAR-T)的研發與臨床應用(yòng)發展迅猛。在美國(guó)臨床試驗網站檢索全球CAR-T細胞治療臨床試驗登記數可(kě)以發現,中(zhōng)國(guó)所登記的項目數僅次于美國(guó),居全球第二。迄今為(wèi)止,國(guó)内已有(yǒu)近二十家公(gōng)司拿(ná)到了CAR-T細胞療法的臨床批件[1]。
在細胞治療領域方面的監管,我國(guó)借鑒發達國(guó)家的經驗,正在努力推動CAR-T細胞産(chǎn)品的全生命周期監管。2017年12月,《細胞治療産(chǎn)品研究與評價技(jì )術指導原則(試行)》發布[2],對細胞産(chǎn)品的制備工(gōng)藝提出了高要求,建立了細胞治療産(chǎn)品按藥品途徑申報的指導原則。應當注意的是,細胞制品如CAR-T細胞療法與一般藥品相比,仍需額外的監管,其中(zhōng)最重要的部分(fēn)是安(ān)全問題。2019年11月28日,國(guó)家藥品監督管理(lǐ)局食品藥品審核查驗中(zhōng)心官網重磅發布《GMP附錄-細胞治療産(chǎn)品》(征求意見稿)[3],這是國(guó)内首部針對細胞治療産(chǎn)品的GMP附錄,彌補了我國(guó)對細胞治療産(chǎn)品生産(chǎn)質(zhì)量控制法規層面和技(jì )術層面的空白。

CAR-T細胞産(chǎn)品生産(chǎn)過程
CAR-T 産(chǎn)品生産(chǎn)主要分(fēn)為(wèi)三個生産(chǎn)過程:
-
質(zhì)粒生産(chǎn):在CAR-T産(chǎn)品的生産(chǎn)過程中(zhōng),如有(yǒu)質(zhì)粒中(zhōng)間品,應有(yǒu)獨立的質(zhì)粒生産(chǎn)區(qū);
(1)至少包括細菌複蘇、細菌擴增、細菌破碎、質(zhì)粒純化和除菌過濾等工(gōng)藝流程;
(2)質(zhì)粒生産(chǎn)區(qū)内應至少包括發酵、純化和除菌分(fēn)裝(zhuāng)三個功能(néng)區(qū),其中(zhōng)發酵和純化功能(néng)區(qū)至少為(wèi)控制區(qū),除菌分(fēn)裝(zhuāng)功能(néng)區(qū)的潔淨度至少為(wèi)“C+A”;
(3)應注意消毒滅菌工(gōng)作(zuò),以避免不同種質(zhì)粒或不同批次質(zhì)粒的交叉污染。
-
病毒載體(tǐ)生産(chǎn):
(1)至少包括細胞擴增、質(zhì)粒轉染(如有(yǒu))、病毒收獲、病毒純化和除菌過濾等工(gōng)藝流程;
(2)病毒載體(tǐ)生産(chǎn)區(qū)應至少分(fēn)為(wèi)細胞培養、病毒轉染、病毒純化和除菌過濾等功能(néng)區(qū);
(3)病毒載體(tǐ)的生産(chǎn)區(qū)應符合藥品 GMP 要求,應注意消毒滅菌工(gōng)作(zuò),以避免不同批次的交叉污染及外源性微生物(wù)污染。
-
CAR-T 産(chǎn)品生産(chǎn):
(1)至少包括細胞分(fēn)離、細胞分(fēn)選(如有(yǒu))、T 細胞激活、病毒感染、細胞擴增、細胞收獲和細胞冷凍(如有(yǒu))等工(gōng)藝流程;
(2)CAR-T産(chǎn)品生産(chǎn)區(qū)應至少分(fēn)為(wèi)體(tǐ)細胞分(fēn)離分(fēn)選、細胞擴增和細胞冷凍等功能(néng)區(qū);
(3)CAR-T産(chǎn)品的生産(chǎn)區(qū)應符合藥品GMP要求,CAR-T産(chǎn)品的生産(chǎn)應符合無菌技(jì )術操作(zuò)規範。
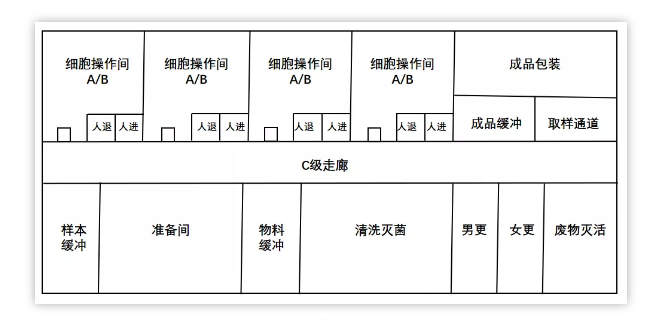
細胞操作(zuò)區(qū),是用(yòng)于進行CAR-T細胞産(chǎn)品的生産(chǎn)操作(zuò)的區(qū)域,包括T細胞分(fēn)離、基因修飾、細胞培養擴增、制劑分(fēn)裝(zhuāng)等。1個細胞操作(zuò)間,同一時間隻能(néng)生産(chǎn)1個批次的産(chǎn)品,細胞操作(zuò)時間約2~3 h,培養時間約10~15天。房間環境潔淨級别為(wèi)B級,應注意避免交叉污染。生物(wù)廢棄物(wù)收集到密閉的袋子或容器,經廢物(wù)通道轉移到C級區(qū),使用(yòng)雙扉式濕熱滅菌櫃進行滅活處理(lǐ)。
質(zhì)粒、病毒載體(tǐ)和 CAR-T 産(chǎn)品的生産(chǎn)區(qū)應分(fēn)别設置為(wèi)獨立區(qū)域,病毒載體(tǐ)和 CAR-T 産(chǎn)品的生産(chǎn)不應共用(yòng)空調淨化系統。除了生産(chǎn)區(qū)域,還需包括質(zhì)控區(qū)和儲存區(qū),質(zhì)控區(qū)包括支原體(tǐ)、内毒素、無菌、微生物(wù)限度、陽性對照、流式細胞儀和分(fēn)子生物(wù)學(xué)等相關檢測,儲存區(qū)包括病毒、菌種和細胞儲存。
CAR-T生産(chǎn)過程對空間滅菌的需求
根據國(guó)家出台的相關政策,CAR-T的臨床生産(chǎn)必須在一個“B+A”的環境中(zhōng),相對于傳統藥品的管理(lǐ),結合CAR-T細胞療法自身的一些特點,如何保證這類産(chǎn)品的安(ān)全、有(yǒu)效和質(zhì)量可(kě)控具(jù)有(yǒu)極大的挑戰性,也對空間滅菌提出了更嚴格的要求。
CAR-T細胞治療不同于傳統藥物(wù),是一種基于整合了CAR基因的自體(tǐ)T細胞療法,生産(chǎn)過程需無菌操作(zuò),屬于非最終滅菌的無菌産(chǎn)品,且不能(néng)無菌過濾。
選擇CAR-T細胞治療的病人一般都處于腫瘤的終末期,時間就是生命,必須在盡可(kě)能(néng)短的時間内完成從抽血到給藥的過程,同時對CAR-T的藥物(wù)安(ān)全和質(zhì)量要求較高。
CAR-T細胞治療屬于個性化治療産(chǎn)品,一個病人就是一個批次,生産(chǎn)規模不大,生産(chǎn)周期較短,滅菌需求靈活多(duō)變:對滅菌循環的周期和批次要求非常高,批次之間對環境進行消毒滅菌不僅要徹底,還必須在時間上比較迅速,這也就限制了一些傳統的消毒滅菌方式的應用(yòng),比如甲醛滅菌停産(chǎn)周期較長(cháng)且有(yǒu)殘留和紫外消毒效果無法保證。
氣化過氧化氫滅菌技(jì )術已成為(wèi)各國(guó)藥典、GMP、消毒滅菌技(jì )術規範所推薦的方法,滅菌工(gōng)藝已經非常成熟,重複性好,有(yǒu)專門的化學(xué)指示劑和生物(wù)指示劑驗證過氧化氫氣體(tǐ)分(fēn)布均勻情況和無菌保證水平。而幹法移動式的VHP滅菌設備因其滅菌效果好,物(wù)料兼容性優,最近幾年在空間滅菌領域得到了很(hěn)大的應用(yòng)。
與傳統的甲醛熏蒸滅菌相比,幹法VHP空間滅菌循環周期短,一般隻需要4-6小(xiǎo)時即可(kě)完成,并且無有(yǒu)害消毒劑殘留,這一點可(kě)以滿足CAR-T細胞的生産(chǎn)工(gōng)藝特點,方便企業的生産(chǎn)時間管理(lǐ);同時移動式的設備自帶腳輪,可(kě)以随意移動部署,可(kě)對多(duō)個區(qū)域靈活滅菌,更加符合CAR-T細胞生産(chǎn)車(chē)間體(tǐ)積小(xiǎo)但數量多(duō),空調機組複雜的特點;與空調機組固定式的VHP滅菌相比,也更加安(ān)全,同時固定投資成本小(xiǎo),運行能(néng)源消耗成本低,便于企業提高經濟效益。

德(dé)國(guó)PEA是一家專注于氣化過氧化氫滅菌的公(gōng)司,目前有(yǒu)兩款不同型号的幹法移動式氣化過氧化氫發生器,可(kě)分(fēn)别滿足不同大小(xiǎo)空間的滅菌需求:MLT zeta單台發生器最大滅菌體(tǐ)積可(kě)達600m³,适用(yòng)于GMP車(chē)間,生物(wù)安(ān)全實驗室等大體(tǐ)積空間的滅菌;MLT19ii單台發生器最大滅菌可(kě)達200立方,特别适用(yòng)于CAR-T細胞治療行業GMP車(chē)間的滅菌,體(tǐ)積小(xiǎo),滅菌周期短,部署靈活,滅菌效果可(kě)靠。


